
Сложные вещества, состоящие из атомов водорода и кислотного остатка, называются минеральными или неорганическими кислотами. Кислотным остатком являются оксиды и неметаллы, соединённые с водородом. Главное свойство кислот – способность образовывать соли.
Кроме того, в соответствии со свойствами кислоты классифицируются по следующим признакам:
- растворимость: растворимые (HNO3, HCl) и нерастворимые (H2SiO3);
- летучесть: летучие (H2S, HCl) и нелетучие (H2SO4, H3PO4);
- степень диссоциации: сильные (HNO3) и слабые (H2CO3).
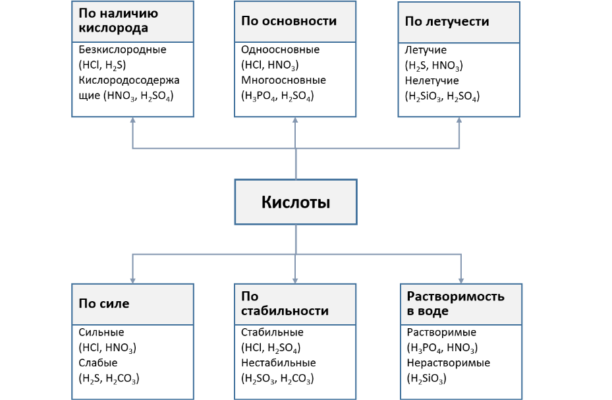
Для обозначения минеральных кислот используются традиционные и тривиальные названия. Традиционные названия соответствуют наименованию элемента, который образует кислоту с добавлением морфем -ная, -овая, а также -истая, -новатая, -новатистая для обозначения степени окисления.
Получение
Основные методы получения кислот представлены в таблице.
|
Метод |
Описание |
Примеры |
|
Взаимодействие простых веществ |
Образование бескислородных кислот |
– H2 + Cl2 = 2HCl; – H2 + S = H2S |
|
Взаимодействие оксидов с водой |
Образование кислородных кислот |
SO3 + H2O = H2SO4 |
|
Взаимодействие солей с растворами кислот |
Получение слабых кислот |
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl |
|
Электролиз |
Под действием электричества водные растворы солей образуют сильные кислоты |
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4 |
Свойства
Большинство кислот – жидкости с кислым вкусом. Вольфрамовая, хромовая, борная и несколько других кислот находятся в твёрдом состоянии при нормальных условиях. Некоторые кислоты (Н2СО3, H2SO3, HClO) существуют только в виде водного раствора и относятся к слабым кислотам.

Кислоты – активные вещества, реагирующие:
- с металлами:
Ca + 2HCl = CaCl2 + H2;
- с оксидами:
CaO + 2HCl = CaCl2 + H2O;
- с основанием:
H2SO4 + 2KOH = K2SO4 + 2H2O;
- с солями:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O.
Все реакции сопровождаются образованием солей.
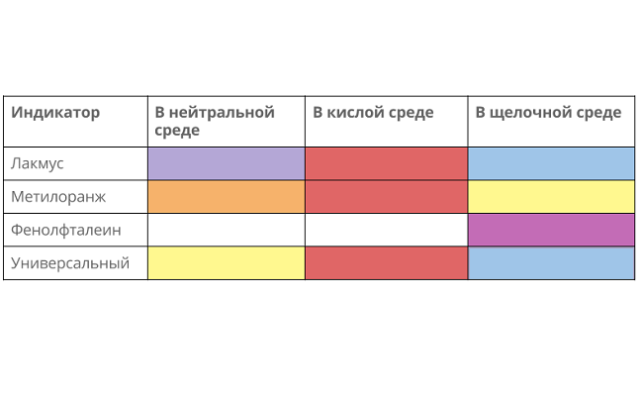
Возможна качественная реакция с изменением цвета индикатора:
- лакмус окрашивается в красный;
- метил оранж – в розовый;
- фенолфталеин не меняется.
Химические свойства минеральных кислот определяются способностью диссоциироваться в воде с образованием катионов водорода и анионов водородных остатков. Кислоты, реагирующие с водой необратимо (диссоциируются полностью) называются сильными. К ним относятся хлорная, азотная, серная и хлороводородная.
Что мы узнали?
Неорганические кислоты образованы водородом и кислотным остатком, которым являются атомы неметалла или оксид. В зависимости от природы кислотного остатка кислоты классифицируются на бескислородные и кислородсодержащие. Все кислоты имеют кислый вкус и способны диссоциироваться в водной среде (распадаться на катионы и анионы). Кислоты получают из простых веществ, оксидов, солей. При взаимодействии с металлами, оксидами, основаниями, солями кислоты образуют соли.