
Ковалентная связь – это связь, связывающая чаще всего атомы неметаллов молекулах и кристаллах. О том, какую химическую связь называют ковалентной говорим в этой статье.
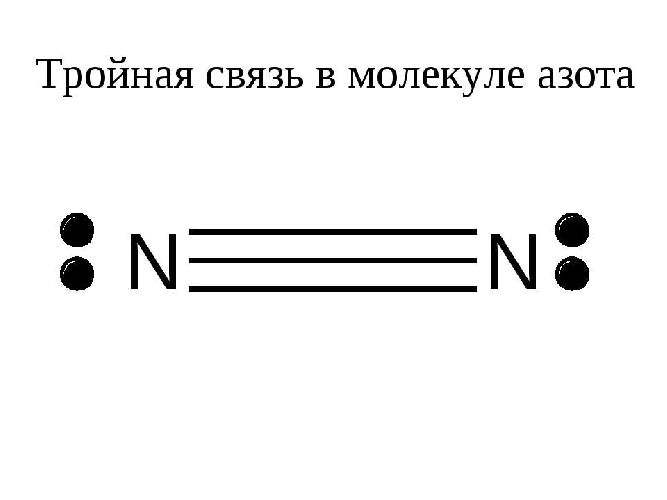
Чем выше кратность связи, тем прочнее молекула: наличие тройной связи объясняет высокую химическую устойчивость молекул азота.
Образование и виды ковалентной связи
Существуют два механизма образования ковалентной связи: обменный механизм и донорно-акцепторный механизм:
- обменный механизм. При обменном механизме для образования общей электронной пары два связывающихся атома предоставляют по одному неспаренному электрону. Именно так происходит, например, при образовании молекулы водорода.
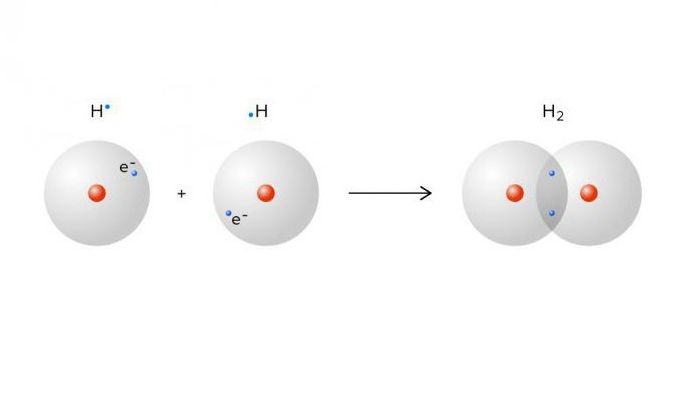
Общая электронная пара принадлежит каждому из связанных атомов, то есть электронная оболочка у них завершена.
- донорно-акцепторный механизм. При донорно-акцепторном механизме общую электронную пару представляет один из связывающихся атомов, тот, который является более электроотрицательным. Второй атом представляет свободную орбиталь для общей электронной пары.
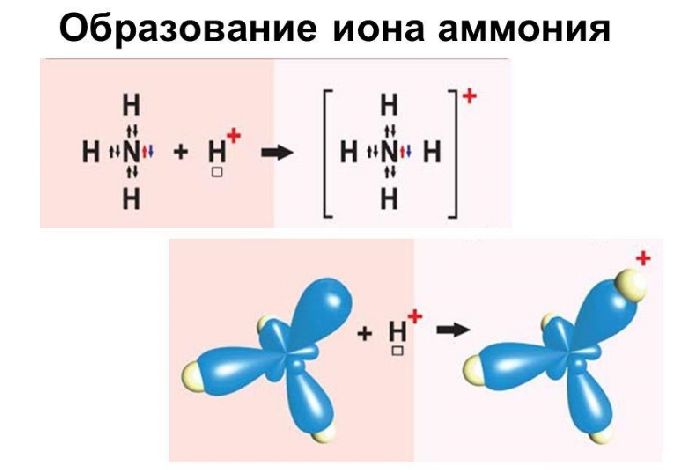
Так образуется ион аммония NH4 +. Этот положительно заряженный ион (катион) образуется при взаимодействии газа аммиака с любой кислотой. В растворе кислоты существуют катионы водорода (протоны), в водородной среде образующие катион гидроксония H3O+. Формула аммиака NH3: молекула состоит из одного атома азота и трех атомов водорода, связанных одинарными ковалентными связями по обменному механизму. У атома азота остается при этом одна неподеленная электронная пара. Ее он предоставляет в качестве общей, как донор, иону водорода H+, имеющему свободную орбиталь.
Ковалентная химическая связь в химических веществах может быть полярной и неполярной. Связь не имеет дипольного момента, то есть полярности, если связаны два атома одного и того же элемента, имеющие одно и то же значение электроотрицательности. Так, в молекуле водорода связь неполярная.
В молекуле хлороводорода HCl ковалентной одинарной связью соединены атомы с разной электроотрицательностью. Общая электронная пара оказывается сдвинутой в сторону хлора, у которого выше сродство к электрону и электроотрицательность. Возникает дипольный момент, связь становится полярной. При этом происходит частичное разделение заряда: атом водорода становится положительным концом диполя, а атом хлора – отрицательным.
Любая ковалентная связь обладает следующими характеристиками: энергия, длина, кратность, полярность, поляризуемость, насыщаемость, направленность в пространстве
Что мы узнали?
Ковалентная химическая связь образуется перекрытием пары валентных электронных облаков. Этот вид связи может образовываться по донорно-акцепторному механизму, а также по обменному механизму. Ковалентная связь бывает полярной и неполярной и характеризуется наличием длины, кратности, полярности, направленности в пространстве.