
Химические свойства щелочных и щелочноземельных металлов схожи. На внешнем энергетическом уровне щелочных металлов находится один электрон, щелочноземельных – два. При реакциях металлы легко расстаются с валентными электронами, проявляя свойства сильного восстановителя.
Могут реагировать с органическими кислотами и спиртами.
Щелочноземельные
Во II группе таблицы Менделеева находятся щелочноземельные металлы:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
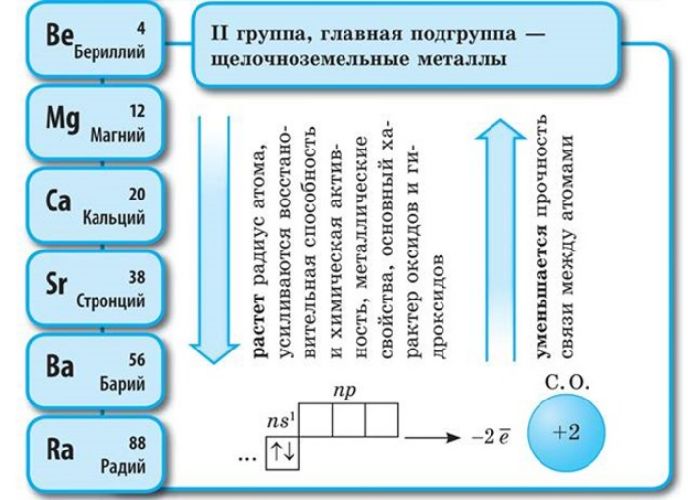
В отличие от щелочных металлов они более твёрдые. Ножом можно разрезать только стронций. Наиболее плотный металл – радий (5,5 г/см3).
Бериллий взаимодействует с кислородом только при нагревании до 900°С. С водородом и водой не реагирует при любых условиях. Магний окисляется при температуре 650°С и взаимодействует с водородом под высоким давлением.
В таблице отражены основные химические свойства щелочноземельных металлов.
|
Реакция |
Особенности |
Уравнение |
|
С кислородом |
Образуют оксидные плёнки. При нагревании до 500°С самовоспламеняются |
2Mg + O2 → 2MgO |
|
С водородом |
При высокой температуре образуют гидриды |
Sr + H2 → SrH2 |
|
С галогенами и неметаллами |
Реагируют при нагревании |
– Be + Cl2 → BeCl2; – Mg + S → MgS; – 3Ca + 2P → Ca3P2; – 3Ca + N2 → Ca3N2; – Ba + 2C → BaC2 |
|
С водой |
При комнатной температуре |
Mg + 2H2O → Mg(OH)2 + H2 |
|
С кислотами |
Реагируют все металлы с образованием солей |
4Ca + 10HNO3 (конц.) → 4Ca(NO3)2 + N2O + 5H2O |
|
Со щелочами |
Реагирует только бериллий |
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 |
|
Замещение |
Замещают менее активные металлы в оксидах. Исключение – бериллий |
2Mg + ZrO2 → Zr + 2MgO |
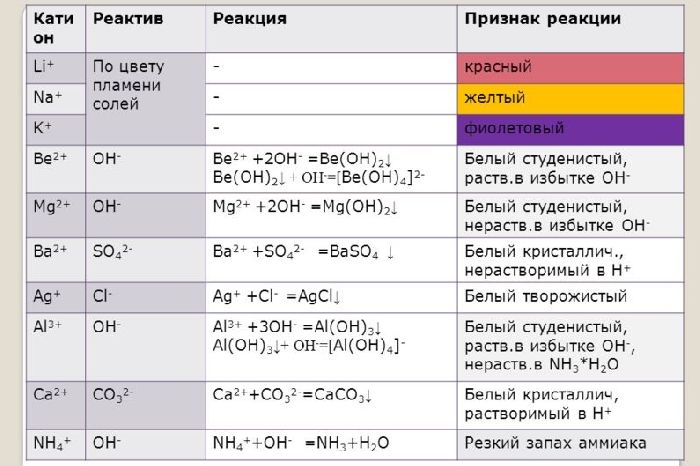
Ионы щелочных и щелочноземельных металлов в солях легко обнаружить по изменению цвета пламени. Соли натрия горят жёлтым пламенем, калия – фиолетовым, рубидия – красным, кальция – кирпично-красным, бария – жёлто-зелёным. Соли этих металлов используют для создания фейерверков.
Что мы узнали?
Щелочные и щелочноземельные металлы – активные элементы периодической таблицы, вступающие в реакции с простыми и сложными веществами. Щелочные металлы более мягкие, бурно реагируют с водой и галогенами, легко окисляются на воздухе, образуя оксиды, пероксиды, надпероксиды, взаимодействуют с кислотами и аммиаком. При нагревании вступают в реакцию с неметаллами. Щелочноземельные металлы реагируют с неметаллами, кислотами, водой. Бериллий не взаимодействует с водородом и водой, но реагирует со щелочами и с кислородом при высокой температуре.