Количество ковалентных связей, которые может образовывать атом, называется валентностью элемента. Валентные возможности атомов обусловлены наличием валентных электронов на внешнем энергетическом уровне.
Валентные возможности
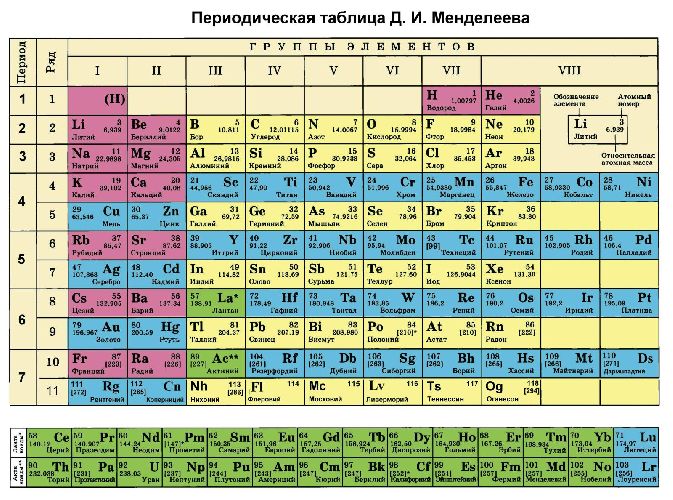
Чтобы оценить валентные возможности атомов химических элементов, необходимо подробно рассмотреть распределение электронов на энергетических уровнях.
Валентность соответствует числу неспаренных электронов, располагающихся на s- и р-орбиталях внешнего энергетического уровня. Валентные электроны атомов элементов, входящих в побочные группы периодической таблицы, располагаются на s-орбитали внешнего уровня и d-орбиталях, образующих внешний подуровень.
В обычном (стационарном) состоянии электроны занимают определённое положение в атоме. Стационарная электронная конфигурация зафиксирована в таблице Менделеева. При возбуждённом состоянии (реакции с другими элементами) энергия атома перераспределяется, и электроны меняют своё положение.
Рассмотрим пример. Атом фосфора в стационарном положении имеет электронную конфигурацию 1s22s22p63s23p3. Это значит, что 15 электронов распределены по трём уровням. На внешнем уровне, включающем s- и p-орбитали, находятся пять валентных электронов. При этом три электрона на p-орбитали неспаренные, а два электрона на s-орбитали образуют пару. Соответственно, три неспаренных электрона могут образовывать ковалентные связи, и валентность фосфора равна трём.
Фосфор находится в V группе, главной подгруппе. Это значит, что в атоме находится пустой d-подуровень. В возбуждённом состоянии спаренные электроны s-уровня распариваются, и один электрон переходит на d-подуровень. Образуется пять свободных, неспаренных электронов. Соответственно, атом фосфора приобретает пятую валентность.
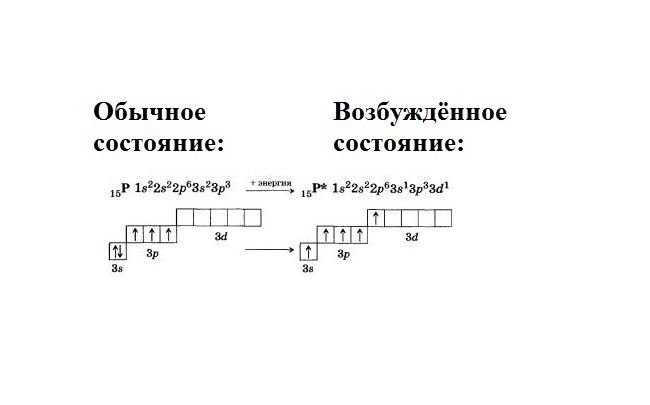
Распаривание происходит с затратой энергии. Расход энергии компенсируется образованием ковалентных связей с высвобождением энергии.
В зависимости от возможности переходить в возбуждённое состояние элементы делятся на две группы: с переменной и постоянной валентностью. Постоянную валентность (соответствует номеру группы) имеют щелочные, щелочноземельные металлы, фтор и алюминий. Переменная валентность присуща всем остальным элементам. Инертные газы не вступают в реакции, поэтому считается, что валентность у них отсутствует.
Что мы узнали?
Валентность показывает, сколько атомов может присоединить элемент посредством ковалентных связей. Значение валентности совпадает с количеством электронов на внешнем энергетическом уровне и соответствует номеру группы периодической таблицы, в которой находится элемент. Из-за возможности переходить в возбуждённое состояние большинство элементов имеют непостоянную валентность. Одинаковую валентность в любом состоянии сохраняют активные металлы и фтор.