
Валентность простых веществ можно определить по таблице Менделеева или таблице валентности химических элементов. Что такое валентность и как определить валентность элемента – на эти вопросы отвечает наша статья.
Вокруг ядра движутся на разном расстоянии от ядра отрицательно заряженные электроны. Их количество также соответствует порядковому номеру элемента. Самый последний уровень занимают валентные электроны. Из-за большого расстояния от ядра они теряют с ним связь и легко спариваются с внешними электронами другого атома. За счёт образовавшейся ковалентной связи формируется новое вещество, состоящее из нескольких атомов.
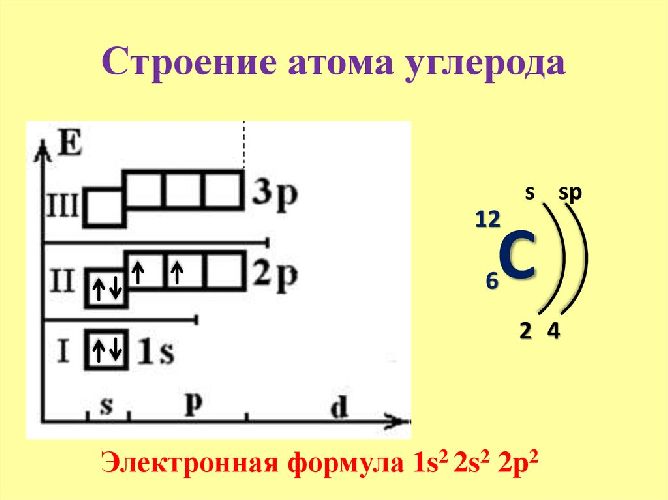
Количество электронов на внешнем уровне определяет валентность элемента и, соответственно, количество возможных химических связей.
Валентность элементов
Все элементы можно разделить на три группы:
- с постоянной валентностью;
- с переменной валентностью;
- с нулевой валентностью.
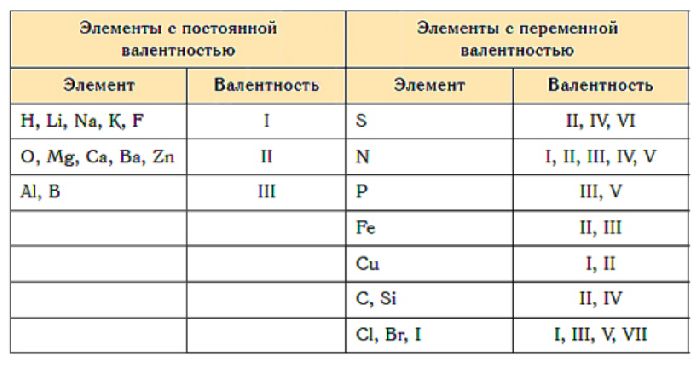
Постоянная валентность химических элементов не меняется:
- у щелочных металлов, фтора (I);
- у щелочноземельных металлов, кислорода (II);
- у алюминия (III).
Переменная валентность характерна остальным элементам. Атомы этих элементов содержат d-подуровень, который может принимать электроны с s- и p-подуровней. В результате спаренные электроны распариваются и образуют дополнительные связи. Один элемент может проявлять I-VII валентности.
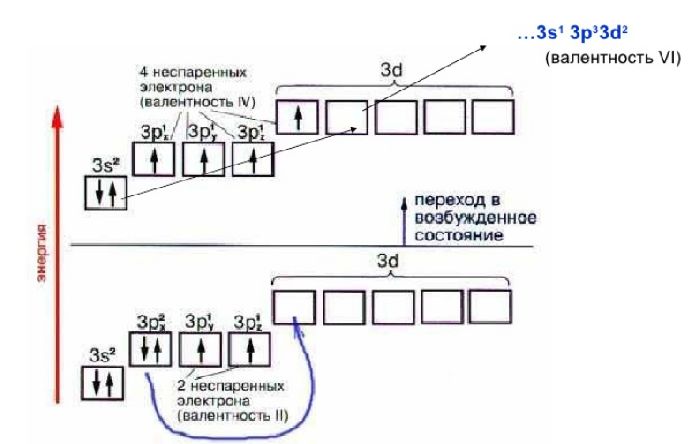
Так называемую нулевую валентность имеют инертные или благородные газы. На внешнем энергетическом уровне могут содержать до восьми электронов. Однако эти элементы химически неактивны и не образуют связи с другими атомами.
Валентность показывает, сколько атомов элементов находится в веществе. Индексы элементов высчитываются как кратное валентностей, поочерёдно поделённое на значение валентности элементов. Например, валентность Na – I, O – II, общее кратное – 2 (1 ∙ 2). Поделив 2 сначала на I, затем на II, получаем формулу соединения Na2O.
Как определить
Запоминать валентность каждого элемента необязательно. Достаточно посмотреть в таблицу Менделеева или использовать специальную таблицу валентности. В периодической таблице высшей валентности соответствует номер группы. Низшую валентность можно узнать, отняв от восьми номер группы.
Однако могут быть исключения. Например, кремний находится в IV группе, его высшая валентность – IV. Воспользовавшись формулой вычисления высшей валентности, можно прийти к выводу, что низшей валентности у кремния нет, она всегда равна IV. Однако это не так. Низшая валентность кремния – II. Другой пример: высшая валентность азота – V. Но элемент эту валентность проявляет редко, гораздо чаще – II и III.
По формуле вещества можно определить переменную валентность одного из элементов. Для этого известную (постоянную) валентность одного элемента умножают на соответствующий ему индекс. Получившееся число делят на индекс определяемого элемента. Например, вычисление валентности фосфора в соединении P2O5: 2 ∙ 5 / 2 = 5 (V).
Что мы узнали?
Из урока 8 класса узнали, что такое валентность элементов. Выяснить значение валентности можно из периодической (соответствует номеру группы) или специальной таблицы валентности. Большинство элементов проявляет переменную валентность, которая обуславливается наличием в атомах таких элементов d-подуровня. Постоянную валентность имеют металл I-II групп, кислород, фтор, алюминий. Знать валентность необходимо для составления формул сложных веществ.