
При нагревании сера реагирует с водородом. Образуется ядовитый газ с резким запахом – сероводород. По-другому называется сернистым водородом, сульфидом водорода, дигидросульфидом.
В промышленности получают несколькими способами:
- реакцией кислот с сульфидами:
FeS + 2HCl → FeCl2 + H2S;
- воздействием воды на сульфид алюминия:
Al2S3 + 6H2O → 2Al(OH)3 + 3H2S;
- сплавлением серы с парафином:
С18Н38 + 18S → 18H2S + 18С.
Наиболее чистый газ получается при прямом взаимодействии водорода и серы. Реакция протекает при 600°С.
Физические свойства
Дигидросульфид – бесцветный газ с запахом протухших яиц и сладковатым вкусом. Это ядовитое вещество, опасное в больших концентрациях. Благодаря молекулярному строению в обычных условиях сернистый водород не сжижается.
Общие физические свойства сернистого водорода:
- плохо растворяется в воде;
- проявляет свойства сверхпроводника при температуре -70°С и давлении 150ГПа;
- огнеопасен;
- растворяется в этаноле;
- сжижается при -60,3°С;
- превращается в твёрдое вещество при -85,6°С;
- плавится при -86°С;
- кипит при -60°С;
- разлагается на простые вещества (серу и водород) при 400°С.
При обычных условиях можно приготовить раствор сероводорода (сероводородную воду). Однако сернистый водород не вступает в реакцию с водой. На воздухе раствор быстро окисляется и мутнеет из-за выделения серы. Сероводородная вода проявляет слабые свойства кислоты.

Химические свойства
Сернистый водород – мощный восстановитель. Основные химические свойства вещества описаны в таблице.
|
Реакция |
Описание |
Уравнение |
|
С кислородом |
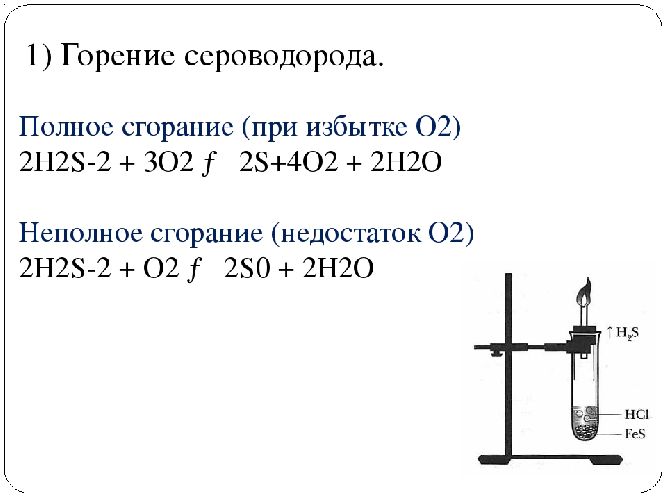
Горит на воздухе голубым пламенем с образованием диоксида серы. При недостатке кислорода образуется сера и вода |
– 2H2S + 4O2 → 2H2O + 2SO2; – 2H2S + O2 → 2S + 2H2O |
|
С окислителями |
Окисляется до диоксида серы или серы |
– 3H2S + 4HClO3 → 3H2SO4 + 4HCl; – 2H2S + SO2 → 2H2O + 3S; – 2H2S + H2SO3 → 3S + 3H2O |
|
Со щелочами |
При избытке щёлочи образуются средние соли, при отношении 1:1 – кислые |
– H2S + 2NaOH → Na2S + 2H2O; – H2S + NaOH → NaHS + H2O |
|
Диссоциации |
Ступенчато диссоциирует в растворе |
– H2S ⇆ H+ + HS–; – HS– ⇆ H+ + S2- |
|
Качественная |
Образование чёрного осадка – сульфида свинца |
H2S + Pb(NO3)2 → PbS↓ + 2HNO3 |
Сернистый водород – токсичный газ, поэтому его применение ограниченно. Большая часть производимого сероводорода используется в промышленной химии для производства серы, сульфида, серной кислоты.
Что мы узнали?
Из темы урока узнали о строении, получении и свойствах сероводорода или сернистого водорода. Это бесцветный газ с неприятным запахом. Является токсичным веществом. Образует сероводородную воду, не вступая во взаимодействие с водой. В реакциях проявляет свойства восстановителя. Реагирует с кислородом воздуха, сильными окислителями (оксидами, кислородными кислотами), со щелочами. Диссоциирует в растворе в два этапа. Сернистый водород используется в химической промышленности для изготовления производных веществ.