
Азотную кислоту впервые стали получать ещё в XVII веке. Современный лабораторный метод предполагает получение кислоты из нитратов. Для получения азотной кислоты в промышленности используется метод окисления аммиака.
Азотная кислота в небольшом количестве образуется в дождевой воде при разрядах молнии.
Получение
Азотную кислоту впервые получили алхимики из селитры и железного купороса при термической реакции:
В современной химии существуют лабораторные и промышленные способы получения азотной кислоты. В лабораториях кислоту получают путём нагревания смеси из нитратов и концентрированной серной кислоты:
В промышленности азотную кислоту получают окислением аммиака. Метод осуществляется в три этапа.
Сначала аммиак окисляют на платиновых катализаторах до оксида азота (II):
Это реакция необратима.
Оксид азота (II) или монооксид окисляют до диоксида или оксида азота (IV):
Конечным этапом является поглощение диоксида азота водой в избытке кислорода:
Все реакции протекают с выделением тепла, т.е. являются экзотермическими. Две последние реакции обратимы, поэтому итоговая концентрация чистой азотной кислоты невысока (45-58 %).
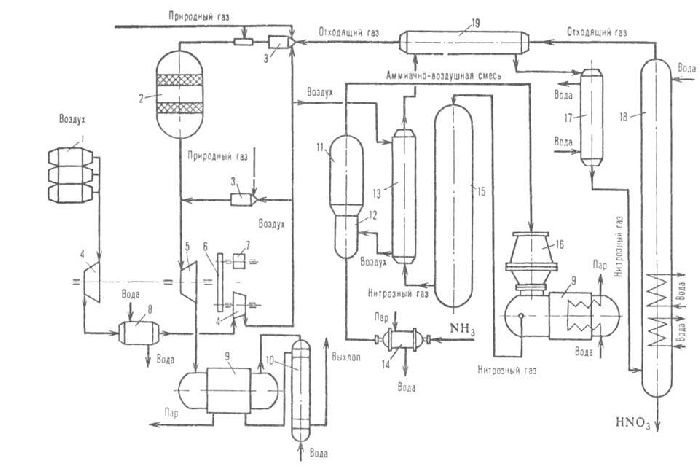
Для повышения концентрации в реакции оксида азота (IV) с водой смещают равновесие, увеличивая давление. Также разбавленную азотную кислоту могут смешивать с серной кислотой и нагревать. Азотная кислота испаряется и конденсируется.
Лабораторный метод получения азотной кислоты обнаружил немецкий алхимик Иоганн Рудольф Глаубер в XVII веке.

Применение
Азотная кислота используется:
- при производстве удобрений;
- в изготовлении взрывчатых веществ;
- в качестве окислителя ракетного топлива;
- для травления печатных форм в типографии;
- при изготовлении красок и лаков;
- в производстве лекарств;
- для определения золота в сплавах;
- для получения органических соединений.
Азотная кислота ядовита. При попадании на кожу разрушает белок, оставляя долго заживающие язвы.
Что мы узнали?
Азотную кислоту получают промышленным и лабораторным путём. В промышленности используется метод окисление аммиака, который включает три реакции. Сначала окисляется аммиак, затем оксид азота (II). Конечной реакцией является поглощение диоксида азота водой. Для повышения концентрации в обратимых реакциях повышают давление. В лабораториях кислоту получают действием серной кислоты на нитраты. Азотная кислота используется в промышленности для производства удобрений, взрывчатки, лекарств, красок.