
Аммиак или нитрид водорода – активное соединение, вступающее в реакции с простыми и сложными веществами. В присутствии кислорода происходит окисление аммиака. В зависимости от условий протекания реакции аммиак может окислиться до оксида или азота.
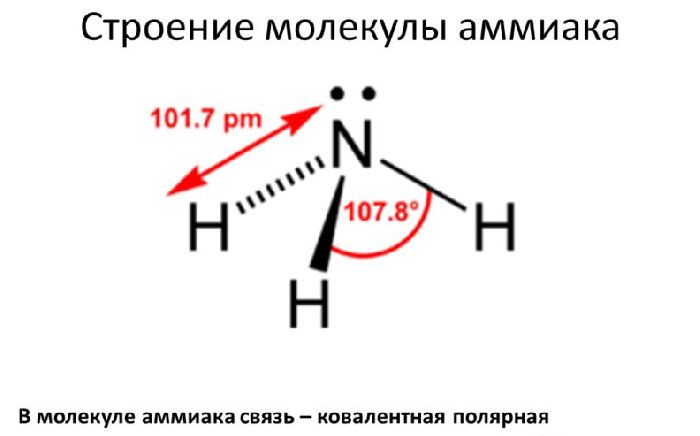
Поэтому азот имеет степень окисления -3, водород – +1.
Аммиак является восстановителем благодаря способности атома азота отдавать оставшиеся электроны и возможности атомов водорода легко отделяться.
Реакции с кислородом
За счёт оставшейся свободной пары электронов азот может окисляться водородом и кислородом. Аммиак легко притягивает катион водорода из воды или кислоты, образуя аммоний (NH4). Это производное аммиака, входящее в состав гидроксида и солей:
- NH3 + Н2О → NH4OH (гидроксид аммония);
- NH3 + HCl → NH4Cl (хлорид аммония);
- NH3 + HNO3 → NH4NO3 (нитрат аммония);
- 2NH4OH + H2SO4 → 2H2O + (NH4)2SO4 (сульфат аммония).

При взаимодействии с кислородом может образовываться свободный азот, оксид азота (II) или (I). Конечный продукт зависит от количества начальных веществ и условий проведения реакции. На воздухе аммиак не горит.
Если на четыре объёма аммиака взять пять объёмов кислорода, то получится оксид азота (II):
Реакция протекает в присутствии катализатора. Над нагретой до 800°С платиной быстро пропускают смесь аммиака с воздухом. Платиновый катализатор могут использовать по-другому. Из платины с примесью родия, рутения, палладия делают сетку, сквозь которую пропускают аммиак и кислород. Также реакция ускоряется в присутствии оксида хрома (III).

Азот можно получить при нагревании концентрированного раствора аммиака в отсутствии катализатора. Сначала раствор нагревают, а затем помещают в условия чистого кислорода (четыре объёма аммиака на три объёма кислорода). Аммиак горит жёлто-зелёным пламенем:
При одинаковом объёме аммиака и кислорода образуется оксид азота (I):
Реакцию окисления проводят для получения разбавленной азотной кислоты. Для этого сначала окисляют NH3 до NO. Затем получившийся газ окисляют до диоксида азота:
Оксид азота (I) для получения кислоты окисляют и пропускают через воду:
Окисление аммиака – экзотермическая реакция, сопровождающаяся выделением тепла.
Что мы узнали?
Аммиак является восстановителем и может окисляться водородом или кислородом. В результате взаимодействия с водородом образуется аммоний – NH4. Это соединение входит в состав солей и гидроксида аммиака. С кислородом аммиак реагирует по-разному, в зависимости от условий. В присутствии катализатора образуется оксид азота (II), при нагревании, но при разных объёмах начальных веществ образуются азот и оксид азота (I).