Химическая реакция – это процесс, при котором одно или несколько исходных веществ превращаются в другие вещества. Так какие химические реакции существуют?

Железо в этой реакции приобретает положительный заряд, что может произойти лишь при отдаче электронов (заряд ядра не изменяется, значит, стало меньше электронов). Хлор получает отрицательный заряд, что может произойти лишь при получении электронов (заряд ядра не изменяется, значит, электронов стало больше). Таким образом, сущность окислительно-восстановительной реакции – в процессе передачи электронов от одних атомов к другим, что выражается в изменении степени окисления.
2. По числу и составу исходных и образующихся веществ:
а) реакция соединения – из двух простых или сложных веществ образуется одно сложное. Примером может служить все та же реакция железа с хлором.
б) реакция разложения – из одного сложного образуются два или более простых или сложных веществ. Эти реакции могут быть, а могут и не быть окислительно-восстановительными. Для проведения они всегда требуют затраты энергии. Например, получение негашеной извести CaO при нагревании известняка CaCO3 не является окислительно-восстановительной реакцией:
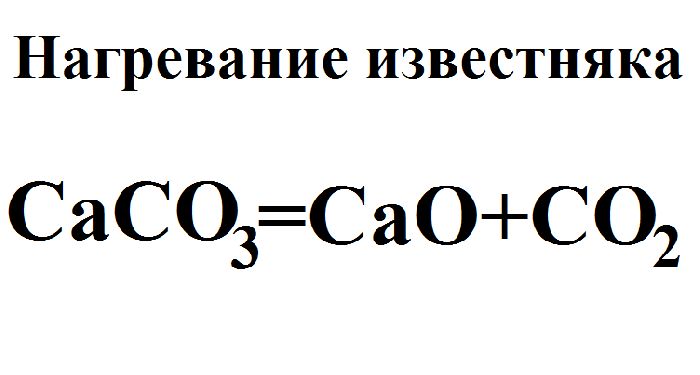
в) реакция замещения – взаимодействие сложного и простого веществ, в результате которого образуются новое сложное и новое простое вещество. Все реакции замещения являются окислительно-восстановительными. Например, взаимодействие цинка с серной кислотой, в результате чего образуются водород и соль цинка:
г) реакция обмена – взаимодействие двух сложных веществ, в результате которого образуются два новых сложных вещества. Например, взаимодействие двух солей поваренной соли NaCl и нитрата серебра AgNO3 :
Реакции обмена не являются окислительно-восстановительными
3. По тепловому эффекту в любой реакции рвутся одни химические связи и образуются другие. Соотношение этих энергетических процессов определяет тепловой эффект реакции.
Реакции, которые идут с выделением тепла, называют экзотермическими, а реакции, которые идут с поглощением тепла, называют эндотермическими.
4. По признаку обратимости. Есть реакции, которые идут до конца, то есть до полного превращения исходных веществ в продукты реакции.
Например:
Такие реакции называют необратимыми. Другие реакции протекают в данных условиях во взаимно противоположных направлениях, то есть продукты реакции одновременно превращаются в исходные вещества. Это обратимые реакции.
Например:
При этом если прямая реакция является экзотермической, то обратная – эндотермической, с тем же количественным значением выделенной или поглощенной энергии.

Что мы узнали?
Тема «Химические реакции» изучается в 11 классе школы. Все химические реакции можно классифицировать по признаку обратимости, тепловому эффекту, по числу и составу исходных и образующих веществ, а также по изменению степени окисления.