
Способность элемента присоединять атомы называется валентностью химических элементов. Валентность помогает правильно расставить индексы элементов в формулах.
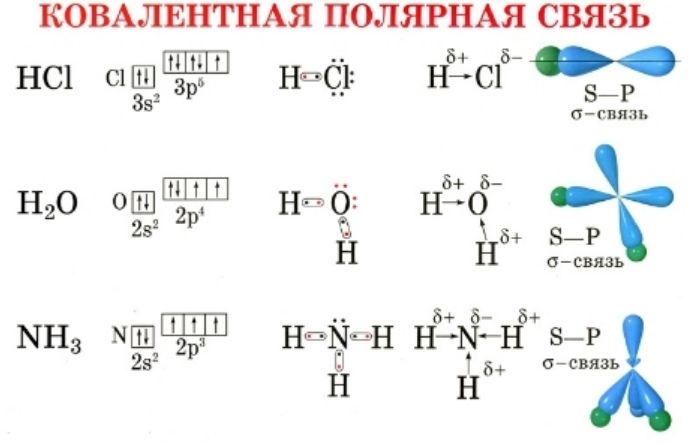
Число атомов равно количеству химических связей. На внешнем энергетическом уровне не могут находиться более восьми электронов, поэтому валентность изменяется от I до VIII.
Не следует путать валентность и степень окисления. Валентность указывает на количество присоединённых атомов, окисление – на условный заряд, который получает элемент при отдаче или принятии электронов. Степень окисления не зависит от вида ионной связи и может быть положительной, отрицательной или нулевой.
Как находится
Помнить, сколько атомов находится на внешнем энергетическом уровне каждого элемента, необязательно. Достаточно воспользоваться таблицей валентности химических элементов или ориентироваться на периодическую таблицу Менделеева. Номер группы, обозначенный римской цифрой, указывает на высшую валентность элемента – максимальное количество химических связей.
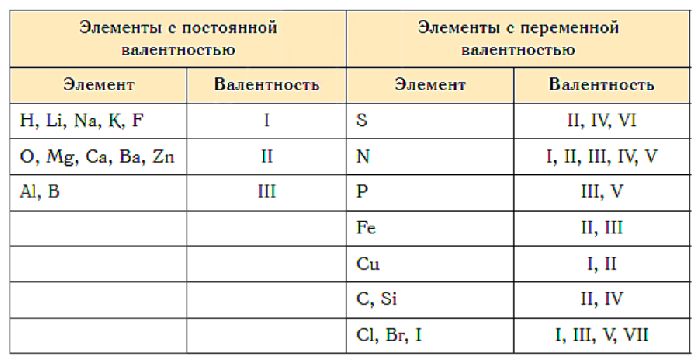
Некоторые элементы имеют две или три валентности. Это связано с тем, что атом может переходить в возбуждённое состояние и образовывать дополнительные связи. Сера может проявлять II, IV или VI валентность в зависимости от соединения:
- H2S (II);
- SO2 (IV);
- SO3 (VI).
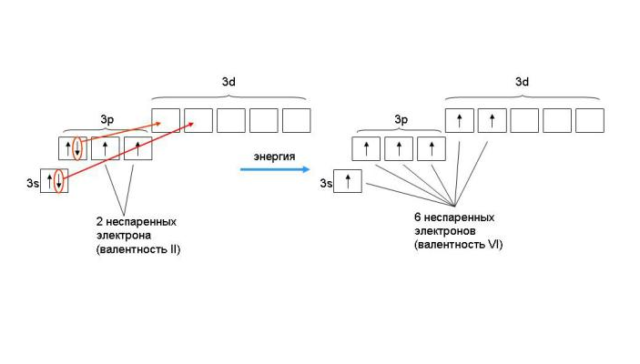
Электронная конфигурация серы – 1s22s22p63s23p4. На внешнем р-уровне находится четыре электрона, два из которых неспаренные, поэтому сера в обычном состоянии двухвалентна. В возбуждённом состоянии один из спаренных электронов переходит на пустой d-подуровень. Атом способен образовать четыре связи, поэтому валентность серы становится IV. При дальнейшем возбуждении на d-подуровень помимо электрона с р-уровня переходит один из спаренных электронов 3s-уровня. В результате неспаренными становятся шесть электронов, и сера проявляет высшую валентность – VI.
Постоянная валентность характерна металлам главных подгрупп и некоторым неметаллам. К ним относятся:
- водород (I);
- кислород (II);
- литий (I);
- бериллий (II);
- бор (III);
- фтор (I);
- натрий (I);
- магний (II);
- алюминий (III);
- калий (I);
- цинк (II);
- кальций (II).
Инертные газы химически неактивны. Поэтому принято считать, что их валентность, вне зависимости от количества атомов на внешнем уровне, равна нулю.
Зачем используется
Валентность важна при составлении формул. С помощью валентности проставляются индексы элементов, а при наличии индексов легко определить валентность элементов.
Чтобы определить индексы, необходимо действовать по следующему алгоритму:
- определить валентность элементов в формуле (Р – V, О – II);
- найти наименьшее кратное валентностей (5∙2=10);
- поочерёдно поделить кратное число на валентности элементов (10/5=2, 10/2=5);
- записать соответствующие символы (Р2О5).
Если формула известна, то можно определить переменную валентность элемента. В формуле Fe2O3 валентность кислорода – 2. Необходимо умножить значение валентности на индекс кислорода и поделить на индекс железа: 2∙3/2=3. Валентность железа – III.
Что мы узнали?
Из урока 8 класса узнали о понятии валентности. Валентность показывает количество возможных химических связей с другим элементом или число атомов, которое элемент может присоединить. Высшую валентность легко определить по таблице Менделеева – её значение соответствует группе элемента. Элементы могут иметь одну или несколько валентностей. Возможность менять валентность связана с возбуждённым состоянием элемента. С помощью валентности можно рассчитывать индексы в химических формулах и определять переменную валентность элемента.