
Выяснить активность простых веществ можно с помощью таблицы электроотрицательности химических элементов. Обозначается как χ. Подробнее о понятии активности читайте в нашей статье.

Полинг составил шкалу электроотрицательности. В соответствии со шкалой Полинга наибольшей электроотрицательностью обладает фтор (4), наименьшей – франций (0,7). Это значит, что фтор является самым сильным окислителем и способен притягивать электроны большинства элементов. Напротив, франций, как и другие металлы, является восстановителем. Он стремится отдать, а не принять электроны.
Электроотрицательность является одним из главных факторов, определяющих тип и свойства образованной между атомами химической связи.
Как определить
Свойства элементов притягивать или отдавать электроны можно определить по ряду электроотрицательности химических элементов. В соответствии со шкалой элементы со значением более двух являются окислителями и проявляют свойства типичного неметалла.
|
Номер элемента |
Элемент |
Символ |
Электроотрицательность |
|
87 |
Франций |
Fr |
0,79 |
|
55 |
Цезий |
Cs |
0,79 |
|
19 |
Калий |
K |
0,82 |
|
37 |
Рубидий |
Rb |
0,82 |
|
56 |
Барий |
Ba |
0,89 |
|
88 |
Радий |
Ra |
0,9 |
|
11 |
Натрий |
Na |
0,93 |
|
38 |
Стронций |
Sr |
0,95 |
|
3 |
Литий |
Li |
0,98 |
|
20 |
Кальций |
Ca |
1,0 |
|
57 |
Лантан |
La |
1,1 |
|
89 |
Актиний |
Ac |
1,1 |
|
70 |
Иттербий |
Yb |
1,1 |
|
58 |
Церий |
Ce |
1,12 |
|
59 |
Празеодим |
Pr |
1,13 |
|
61 |
Прометей |
Pm |
1,13 |
|
95 |
Америций |
Am |
1,13 |
|
60 |
Неодим |
Nd |
1,14 |
|
62 |
Самарий |
Sm |
1,17 |
|
64 |
Гадолиний |
Gd |
1,2 |
|
66 |
Диспрозий |
Dy |
1,22 |
|
39 |
Иттрий |
Y |
1,22 |
|
68 |
Эрбий |
Er |
1,24 |
|
69 |
Тулий |
Tm |
1,25 |
|
71 |
Лютеций |
Lu |
1,27 |
|
96 |
Кюрий |
Cm |
1,28 |
|
94 |
Плутоний |
Pu |
1,28 |
|
90 |
Торий |
Th |
1,3 |
|
97 |
Берклий |
Bk |
1,3 |
|
98 |
Калифорний |
Cf |
1,3 |
|
99 |
Эйнштейний |
Es |
1,3 |
|
100 |
Фермий |
Fm |
1,3 |
|
101 |
Менделевий |
Md |
1,3 |
|
102 |
Нобелий |
No |
1,3 |
|
12 |
Магний |
Mg |
1,31 |
|
40 |
Цирконий |
Zr |
1,33 |
|
93 |
Нептуний |
Np |
1,36 |
|
21 |
Скандий |
Sc |
1,36 |
|
92 |
Уран |
U |
1,38 |
|
73 |
Тантал |
Ta |
1,5 |
|
91 |
Протактиний |
Pa |
1,5 |
|
22 |
Титан |
Ti |
1,54 |
|
25 |
Марганец |
Mn |
1,55 |
|
4 |
Бериллий |
Be |
1,57 |
|
41 |
Ниобий |
Nb |
1,6 |
|
13 |
Алюминий |
Al |
1,61 |
|
81 |
Талий |
Tl |
1,62 |
|
30 |
Цинк |
Zn |
1,65 |
|
23 |
Ванадий |
V |
1,63 |
|
24 |
Хром |
Cr |
1,66 |
|
48 |
Кадмий |
Cd |
1,69 |
|
49 |
Индий |
In |
1,78 |
|
31 |
Галлий |
Ga |
1,81 |
|
26 |
Железо |
Fe |
1,83 |
|
82 |
Свинец |
Pb |
1,87 |
|
27 |
Кобальт |
Co |
1,88 |
|
29 |
Медь |
Cu |
1,9 |
|
75 |
Рений |
Re |
1,9 |
|
14 |
Кремний |
Si |
1,9 |
|
43 |
Технеций |
Tc |
1,9 |
|
28 |
Никель |
Ni |
1,91 |
|
47 |
Серебро |
Ag |
1,93 |
|
50 |
Олово |
Sn |
1,96 |
|
80 |
Ртуть |
Hg |
2 |
|
84 |
Полоний |
Po |
2 |
|
83 |
Висмут |
Bi |
2,02 |
|
5 |
Бор |
B |
2,04 |
|
51 |
Сурьма |
Sb |
2,05 |
|
42 |
Молибден |
Mo |
2,16 |
|
33 |
Мышьяк |
As |
2,18 |
|
15 |
Фосфор |
P |
2,19 |
|
1 |
Водород |
H |
2,2 |
|
77 |
Иридий |
Ir |
2,2 |
|
86 |
Радон |
Rn |
2,2 |
|
85 |
Астат |
At |
2,2 |
|
44 |
Рутений |
Ru |
2,2 |
|
46 |
Палладий |
Pd |
2,2 |
|
76 |
Осмий |
Os |
2,2 |
|
78 |
Платина |
Pt |
2,28 |
|
45 |
Родий |
Rh |
2,28 |
|
74 |
Вольфрам |
W |
2,36 |
|
79 |
Золото |
Au |
2,54 |
|
6 |
Углерод |
C |
2,55 |
|
34 |
Селен |
Se |
2,55 |
|
16 |
Сера |
S |
2,58 |
|
54 |
Ксенон |
Xe |
2,6 |
|
53 |
Йод |
I |
2,66 |
|
36 |
Криптон |
Kr |
2,96 |
|
7 |
Азот |
N |
3,04 |
|
17 |
Хлор |
Cl |
3,16 |
|
8 |
Кислород |
O |
3,44 |
|
9 |
Фтор |
F |
3,98 |
Вещества с электроотрицательностью два и меньше являются восстановителями и проявляют металлические свойства. Переходные металлы, обладающие переменной степенью окисления и относящиеся к побочным подгруппам таблицы Менделеева, имеют значения электроотрицательности в пределах 1,5-2. Ярко выраженными свойствами восстановителя обладают элементы с электроотрицательностью равной или меньше одного. Это типичные металлы.
В ряде электроотрицательности металлические и восстановительные свойства увеличиваются справа налево, а окислительные и неметаллические свойства – слева направо.

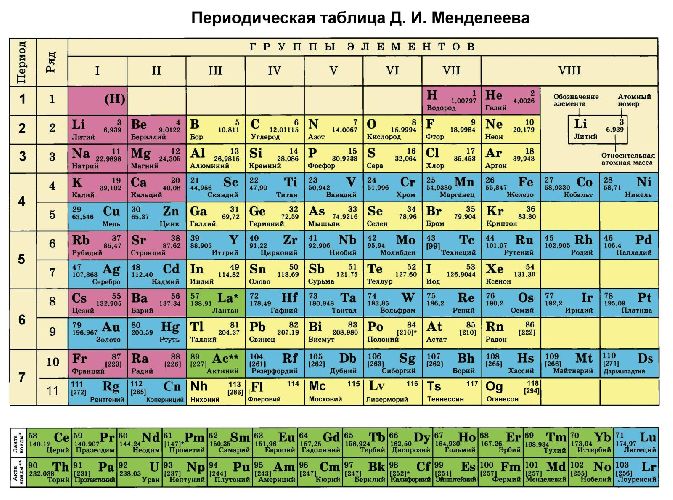
Помимо шкалы Полинга узнать, насколько выражены окислительные или восстановительные свойства элемента можно с помощью периодической таблицы Менделеева. Электроотрицательность увеличивается в периодах слева направо с увеличением порядкового номера. В группах значение электроотрицательности уменьшается сверху вниз.
Что мы узнали?
Электроотрицательность показывает способность элементов отдавать или принимать электроны. Эта характеристика помогает понять, насколько выражены свойства окислителя (неметалла) или восстановителя (металла) у конкретного элемента. Для удобства Полингом была разработана шкала электроотрицательности. Согласно шкале максимальными окислительными свойствами обладает фтор, минимальными – франций. В периодической таблице свойства металлов увеличиваются справа налево и сверху вниз.