
Металлы – твёрдые элементы, сплавы которых широко применяются в промышленности, строительстве и повседневной жизни. Пластичность, твёрдость, тепло- и электропроводность, а также способность к плавке и ковке обусловлены строением металлов.
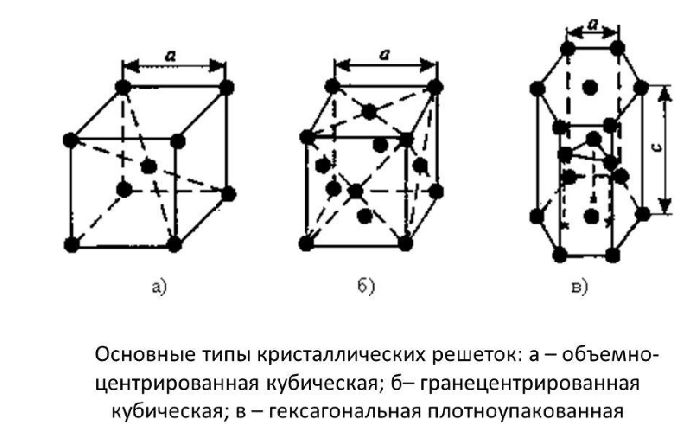
Атомы всех металлов, за исключением ртути, образуют кристаллические решётки. Кристаллическая решётка состоит из повторяющихся комплексов атомов – элементарных кристаллических ячеек, которые бывают трёх видов. Их отличия описаны в таблице строения металлов.
|
Вид решётки |
Характеристика |
Примеры |
|
Кубическая объёмно-центрированная (ОЦК) |
Восемь ионов находятся по углам условного куба, один – в середине |
Fe, Cr, Mo, W, V |
|
Кубическая гранецентрированная |
Ионы располагаются в углах куба и в центре каждой грани. Центр куба свободен |
Cu, Ag, Ni, Pb, Al |
|
Гексагональная плотноупакованная |
Шестигранная призма. В углах и в центре между ними находятся ионы. Посередине призмы лежат ионы, образующие треугольник |
Zn, Ti, Mg, Co, Zr |
Физические свойства
Металлы отличаются от неметаллов характерными физическими свойствами:
- имеют металлический блеск;
- проводят электрический ток и тепло;
- не имеют запаха;
- обладают серебристо-серым цветом (исключение – медь и золото).
Благодаря пластичности и плавке металлы могут образовывать сплавы – смеси химических элементов. Большую часть сплавов составляют металлы, остальное – случайные примеси и специально вводимые вещества. Сплавы отличаются высокой прочностью, упругостью, хрупкостью. Широко применяются сплавы на основе железа (чёрные металлы) и алюминия (цветные металлы).
Высокую электропроводность обуславливают свободные электроны, перемещающиеся по кристаллической решётке под действием электрических полей. При нагревании электропроводность уменьшается.
Виды
Классификация металлов приведена в таблице.
|
Признак |
Вид |
Пример |
|
Температура кипения |
Легкоплавкие (Т<1000°С) |
K, Al, Zn |
|
Тугоплавкие (Т>1000°С) |
Au, Cu, Ni |
|
|
Плотность |
Лёгкие (ρ<5 г/см3) |
Li |
|
Тяжёлые (ρ>5 г/см3) |
Os |
|
|
Твёрдость |
Мягкие – режутся ножом |
Na, Rb, Cs |
|
Твёрдые – используются для резки |
Cr |
В химии по структуре орбиталей атома металла различают s-, p-, d-, f-металлы.
Химические свойства
Металлы являются восстановителями и вступают в реакцию с неметаллами, образуя оксиды, гидроксиды, соли. Самыми активными являются щелочные и щелочноземельные металлы, расположенные в I и II группах таблицы Менделеева. Благородные металлы (Au, Ag, Pt) малоактивны и не взаимодействуют с кислородом и водой.
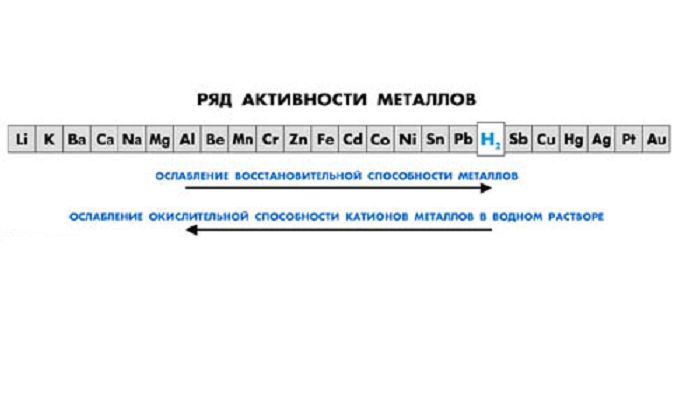
Особенности химического взаимодействия металлов с другими элементами описаны в таблице.
|
Взаимодействие |
Продукты |
Уравнение |
|
С кислородом |
Оксиды |
2Mg + O2 → 2MgO |
|
С серой |
Сульфиды |
Zn + S → ZnS |
|
С азотом |
Нитриды |
6Li + N2 → 2Li3N |
|
С фосфором |
Фосфиды |
3Ca + 2P → Ca3P2 |
|
С галогенами |
Галогениды |
2Na + Cl2 → 2NaCl |
|
С водой |
Гидроксиды |
2Na + 2H2O → 2NaOH + H2 |
|
С кислотами |
Соли |
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 |
|
С солями (замещают менее активные металлы) |
Соль |
2Fe + Cu2SO4 → Fe2SO4 + 2Cu |
Золото растворяется в царской водке (смеси соляной и азотной кислот), серебро – в концентрированной азотной и горячей серной кислотах.

Что мы узнали?
Рассмотрели особенности строения атомов металлов, физические и химические свойства. Металлы состоят из элементарных кристаллических ячеек, отличающихся конфигурацией. Элементы обладают металлическим блеском, электропроводностью, пластичностью, твёрдостью. Металлы – восстановители. Наиболее активные находятся в I и II группах таблицы Менделеева. Металлы реагируют с кислородом, водой, кислотами, галогенами и неметаллами.