
В чистом, несвязанном виде водород в природе практически не встречается. Он может выделяться в незначительных количествах при извержении вулкана или из скважин при добывании нефти (всего 1 % содержится в земной коре). Поэтому существуют искусственные методы получения водорода в промышленности.
Основные способы получения водорода описаны в таблице.
|
Взаимодействие |
Реакция получения |
Побочные продукты |
|
Натрия с водой |
2Na + 2H2O → 2NaOH + H2↑ |
Гидроксид натрия |
|
Гидрида кальция с водой |
CaH2 + 2H2O → Ca(OH)2 + 2H2↑ |
Гидроксид кальция |
|
Гидрида натрия с водой |
NaH + H2O → NaOH + H2↑ |
Гидроксид натрия |
|
Водяного пара с раскалённым железом |
4Н2О + 3Fe → Fe3O4 + 4H2↑ |
Оксид железа (II, III) |
|
Водяного пара с раскалённым коксом (газификация угля) |
H2O + C → CO↑ + H2↑ |
Угарный газ |
|
Метана с водяным паром (разложение метана при 1000°C) |
CH4 + H2O → CO↑ + 3H2↑ |
Угарный газ |
|
Фиолетового фосфора и водяного пара |
2Р + 8Н2О → 2Н3РО4 + 5Н2↑ |
Фосфорная кислота |
|
Цинка с разбавленной соляной кислоты |
Zn + 2HCl → ZnCl2 + H2↑ |
Соль хлорид цинка |
|
Алюминия или кремния со щёлочью и водой |
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Si + 2KOH + H2O → Na2SiO3 + 2H2↑ |
Соль тетрагидроксоалюминат натрия или метасиликат натрия |
|
Разложение метана при высокой температуре |
CH4 → C + 2H2↑ |
Сажа |
|
Окисление метана |
2CH4 + O2 → 2CO + 4H2↑ |
Угарный газ |
|
Электролитический способ разложения воды (добавляют электролиты, например, КОН) |
2H2O → 2H2↑ + O2↑ |
Кислород |
|
Электролиз растворов солей |
2NaCl + 2H2O → 2NaOH + Cl2 + H2↑ |
Гидроксид натрия и свободный хлор |
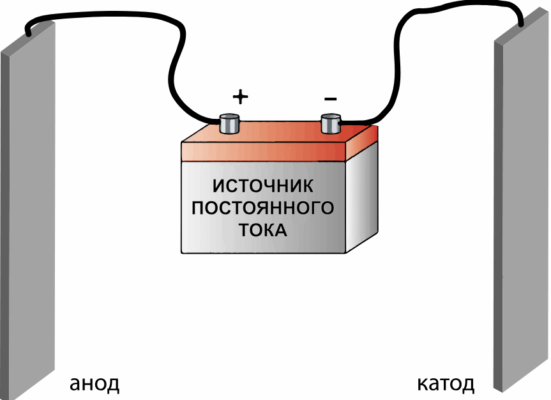
Водород при взаимодействии с кислотами и металлами, содержащими примеси, получается загрязнённым, поэтому проводят процесс очистки. Для этого полученное водородное соединение пропускают через раствор перманганата или бихромата калия, а затем через раствор гидроксида калия и концентрированную серную кислоту.
Использование водорода
Реакции собирания и распознавания водорода необходимы для извлечения чистого газа, который используется в качестве экологического топлива, а также участвует в различных химических реакциях для получения соединений.
Водород применяется в различных отраслях промышленности:
- при производстве аммиака (NH3);
- для получения соляной кислоты (HCl);
- при синтезе метилового спирта;
- для восстановления металлов;
- при сварке (в результате взаимодействия водорода и кислорода выделяется большое количество тепла);
- для получения растительных жиров при производстве маргарина.
Водород использовался для наполнения воздушных шаров и аэростатов. Сегодня сжиженный водород – топливо для ракет.

Что мы узнали?
Из урока 9 класса узнали, как получают водород в промышленных и лабораторных условиях. Водород выделяется в ходе реакций металлов, гидридов, фосфора с водой, при газификации угля, при взаимодействии цинка с соляной кислотой и алюминия или кремния со щёлочью. Водород получают из метана путём его окисления, разложения при высокой температуре или при взаимодействии с водой. Также водород выделяется при электролизе солей и разложении воды.