
Количественная характеристика, показывающая направление реакции и смещение концентрации веществ, называется константой равновесия химической реакции. Константа равновесия зависит от температуры и природы реагентов.
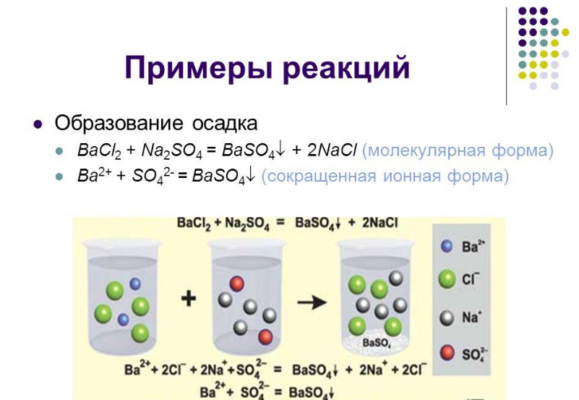
Обратимые реакции возможны только в определённых неизменных условиях. Исходные вещества дают новое вещество, которое тут же распадается на составные части и собирается вновь. Например, в результате реакции 2NO + O2 ↔ 2NO2 оксид азота (IV) легко разлагается на оксид азота (II) и кислород.
Равновесие
Через определённое время скорость обратимой реакции замедляется. Достигается химическое равновесие – состояние, при котором не происходит изменения концентрации исходных веществ и продуктов реакции с течением времени, так как скорость прямой и обратной реакций уравниваются. Равновесие возможно только в гомогенных системах, то есть все реагирующие вещества являются либо жидкостями, либо газами.
Рассмотрим химическое равновесие на примере реакции взаимодействия водорода с йодом:
- прямая реакция –
H2 + I2 ↔ 2HI;
- обратная реакция –
2HI ↔ H2 + I2.
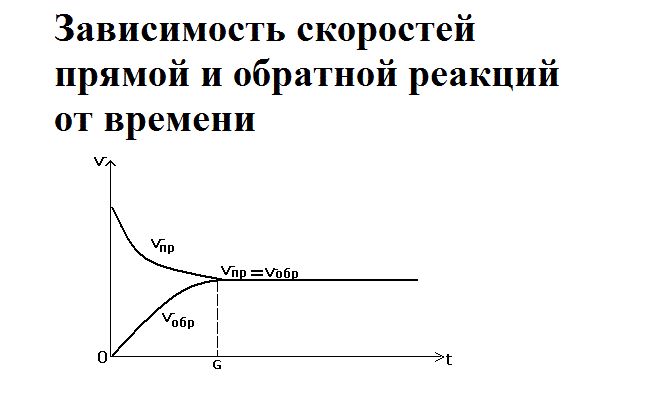
Как только смешиваются два реагента – водород и йод – йодоводорода ещё не существует, так как простые вещества только вступают в реакцию. Большое количество исходных веществ активно реагируют друг с другом, поэтому скорость прямой реакции будет максимальной. При этом обратная реакция не протекает, и скорость её равна нулю.
Скорость прямой реакции можно выразить графически:
где kпр – константа скорости прямой реакции.
Со временем реагенты расходуются, их концентрация снижается. Соответственно, скорость прямой реакции уменьшается. Одновременно с этим увеличивается концентрация нового вещества – йодоводорода. При накоплении он начинает разлагаться, и скорость обратной реакции повышается. Её можно выразить как
Йодоводород в квадрате, так как коэффициент молекулы равен двум.
В определённый момент скорости прямой и обратной реакции уравниваются. Наступает состояние химического равновесия.
Равновесие можно сместить либо в сторону исходных веществ, либо в сторону продуктов реакции. Смещение под воздействием внешних факторов называется принципом Ле Шателье. На равновесие влияют температура, давление, концентрация одного из веществ.
Расчёт константы
В состоянии равновесия обе реакции идут, но при этом концентрации веществ находятся в равновесии (образуются равновесные концентрации), так как уравновешенны скорости (νпр = νобр).
Химическое равновесие характеризуется константой химического равновесия, которая выражается сводной формулой:
Константы скорости реакции можно выразить через соотношение скорости реакции. Возьмём условное уравнение обратной реакции:
Тогда скорости прямой и обратной реакции будут равны:
- νпр = kпр ∙ [A]pa ∙ [B]pb
- νобр = kобр ∙ [C]pc ∙ [D]pd.
Соответственно, если
то
Отсюда можно выразить соотношение констант:
Это соотношение равно константе равновесия:
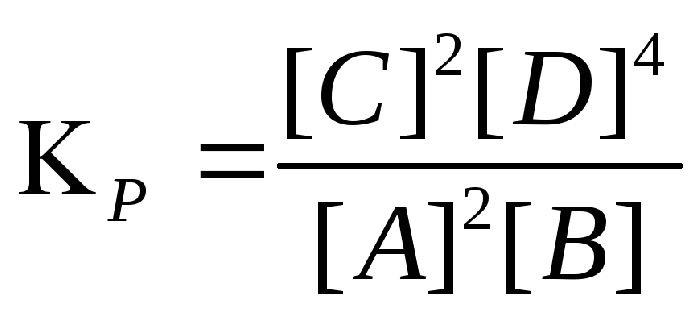
Величина показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции.
Что мы узнали?
Реакции в зависимости от конечных продуктов классифицируются на обратимые и необратимые. Обратимые реакции протекают в обе стороны: исходные вещества образуют конечные продукты, которые разлагаются на исходные вещества. В ходе реакции скорости прямой и обратной реакций уравновешиваются. Такое состояние называется химическим равновесием. Оно может быть выражено как соотношение произведения равновесных концентраций продуктов реакции к произведению разновесных концентраций исходных веществ.