
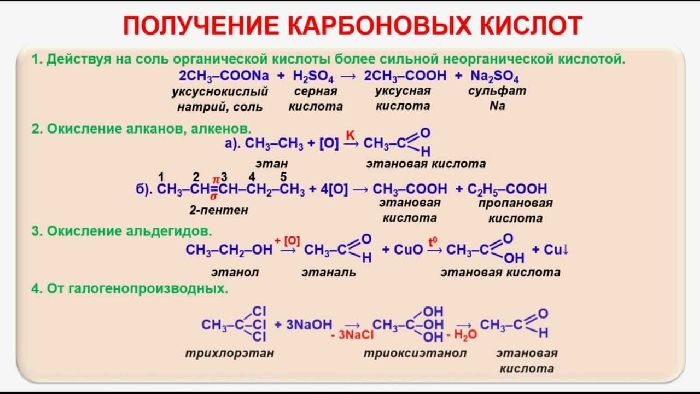
Карбоновые кислоты – органические кислоты. Они входят в состав живых организмов и участвуют в метаболизме. Химические свойства карбоновых кислот обуславливаются наличием карбоксильной группы -СООН. К ним относятся уксусная, муравьиная, щавелевая, масляная и ряд других кислот.
Физические свойства карбоновых кислот:
- температура кипения выше, чем у соответствующих углеводородов и спиртов;
- хорошая растворимость в воде – растворяются на катионы водорода и анионы кислотного остатка (являются слабыми электролитами);
- увеличение числа атомов углерода уменьшает силу кислот.
Карбоновые кислоты имеют прочные водородные связи (прочнее, чем у спиртов), что обуславливается высоким положительным зарядом на атоме водорода в карбоксильной группе.
Взаимодействие
Карбоновые кислоты изменяют окраску индикаторов. Лакмус и метилоранж становятся красными.
В таблице химических свойств карбоновых кислот описано взаимодействие кислот с другими веществами.
|
Реакции |
Результат |
Пример |
|
С металлами |
Выделяется водород, образуются соли |
2CH3COOH + Mg → (CH3COO)2Mg + H2 |
|
С оксидами |
Образуются соль и вода |
2CH3COOH + ZnO → (CH3COO)2Zn + H2O |
|
С основаниями (нейтрализация) |
Образуются соль и вода |
CH3COOH + NaOH → CH3COONa + H2O |
|
С карбонатами |
Выделяются углекислый газ и вода |
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2 |
|
С солями слабых кислот |
Образуется неорганическая кислота |
2CH3COOH + Na2SiO3 → 2CH3COONa + H2SiO3 |
|
С аммиаком или гидроксидом аммония |
Образуется ацетат аммония. При взаимодействии с гидроксидом выделяется вода |
CH3COOH + NH3 → CH3COONH4 CH3COOH + NH4OH → CH3COONH4 + H2O |
|
Со спиртами (этерификация) |
Образуются сложные эфиры |
CH3COOH + C2H5OH → CH3COOC2H5 + H2O |
|
Галогенирование |
Образуется соль |
CH3COOH + Br2 → CH2BrCOOH |
Соли, образующиеся при взаимодействии веществ с муравьиной кислотой, называются формиатами, с уксусной кислотой – ацетатами.
Декарбоксилирование
Отщепление карбоксильной группы называется процессом декарбоксилирования, который происходит в следующих случаях:
- при нагревании солей в присутствии твёрдых щелочей с образованием алканов – RCOONaтв + NaOHтв → RH + Na2CO3;
- при нагревании твёрдых солей – (СН3СОО)2Са → СН3-СО-СН3 + СаСО3;
- при прокаливании бензойной кислоты – Ph-COOH → PhH + CO2;
- при электролизе растворов солей – 2RCOONa + Н2О → R-R + 2CO2 + 2NaOH.
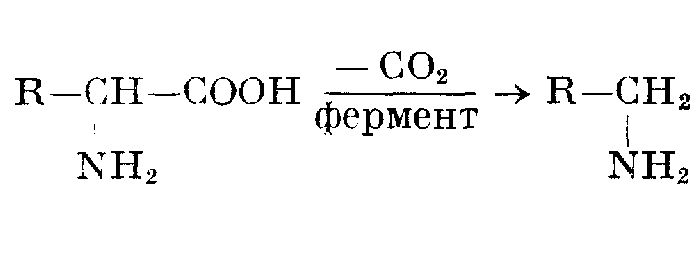
Что мы узнали?
Из урока 10 класса узнали об основных химических и физических свойствах карбоновых кислот. Они образуются при окислении спиртов, альдегидов, бутана, в процессе карбонилирования, разложения, взаимодействия с серной кислотой. Кислоты хорошо растворяются в воде и закипают при более высоких температурах, чем спирты. В процессе декарбоксилирования отщепляется группа -СООН. Карбоновые кислоты взаимодействуют с солями, металлами, оксидами, гидроксидами, солями, аммиаком.