
Алкены – более активный класс веществ, чем алканы. Химические свойства алкенов обусловлены строением их молекул.
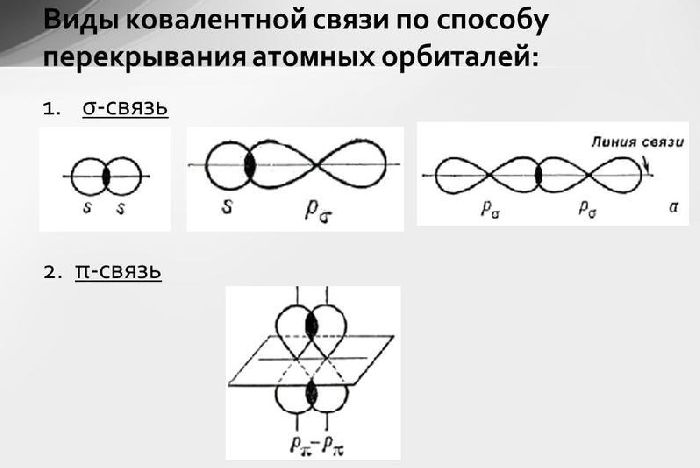
Двойная связь в реакциях присоединения выступает в роли донора электронов. Поэтому алкенам свойственны реакции электрофильного присоединения.
Физические свойства
Общие физические свойства алкенов:
- температура плавления и кипения повышается с увеличением молекулярной массы в гомологическом ряду;
- не растворяются в воде;
- держатся на водной поверхности, так как имеют плотность во много раз меньше плотности воды;
- растворяются в органических растворителях – спиртах, эфирах.
Агрегатное состояние веществ меняется от количества атомов углерода в гомологическом ряду. Алкены с 2-4 атомами углерода – газы. От пептена (C5H10) до гептадецена (C17H34) вещества находятся в жидком состоянии. Алкены, содержащие более 17 атомов углерода, являются твёрдыми телами.

Химические свойства
Особенности и примеры химических свойств алкенов приведены в таблице.
|
Реакция |
Описание |
Уравнения реакций |
|
Гидрирование – присоединение водорода |
Протекает при высоком давлении в присутствии катализатора – никеля, палладия или платины. Образуются алканы – предельные углеводороды |
CH2=CH-CH3 + H2 → CH3-CH2-CH3 |
|
Галогенирование – присоединение галогенов |
Протекает при обычных условиях. Галогены присоединяются по двойной связи. Образуются дигалогеналканы |
– CH2=CH2 + Cl2 → Cl-CH2-CH2-Cl (1,2-дихлорэтан); – CH3-CH=CH-CH3 + Br2 → CH3-CH-Br-CH-Br-CH3 (2,3-дибромбутан) |
|
Гидрогалогенирование – присоединение галогеноводородов |
Реакция электрофильного присоединения. Электрофилом является протон водорода в составе галогена. Образуются галогеналканы |
CH2=CH2 + HCl → CH3-CH2-Cl (хлорэтан) |
|
Гидратация – присоединение воды |
Реакция протекает в присутствии неорганических кислот – серной, фосфорной. Выполняют функцию катализатора и являются источниками водорода. Образуются одноатомные спирты |
CH2=CH2 + H2O → CH3-CH2OH |
|
Полимеризация – увеличение числа атомов |
Протекает в присутствии катализатора, при повышенных давлении и температуре. Таким способом получают полиэтилен, поливинилхлорид, полипропилен |
nCH2=CH2 → (-CH2-CH2-)n |
|
Горение |
Протекает при избытке кислорода |
CH2=CH2 + 3O2 → 2CO2 + H2O |
|
Неполное окисление |
Протекает в присутствии катализатора. Алкен, смешанный с кислородом, пропускают над нагретым серебром. Образуется эпоксид – оксид алкена |
2CH2=CH2 + O2 → 2CH2-O-CH2 |
|
Реакция Вагнера |
Окисление перманганатом калия в щелочной или нейтральной среде. Образуются спирты |
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2KOH + 2MnO2 |
|
Окисление кипящим перманганатом калия в кислой среде |
Образуются карбоновые кислоты |
CH3-CH=CH-CH3 + 4[O] → 2CH3COOH |
При нагревании в присутствии катализатора алкены вступают в реакцию изомеризации. Меняется положение двойной связи или структура углеродного скелета. Например, бутен-1 (положение двойной связи между первым и вторым атомами) превращается в бутен-2 (двойная связь «сдвигается» на второй атом).

Что мы узнали?
Из урока химии 10 класса узнали о химических свойствах алкенов. Двойная связь делает эти вещества более активными, чем алканы. Алкены взаимодействуют с галогенами, кислородом, водой, водородом, галогеноводородами. Большинство реакций протекает в присутствии катализатора при высокой температуре или при повышенном давлении. Из алкенов получаются полимеры. Также под действием катализаторов образуются изомеры.