
Один из наиболее распространённых простых веществ в земной коре – фосфор. В чистом виде не встречается, т.к. имеет высокую активность и быстро вступает в реакции. Входит в состав живых организмов.
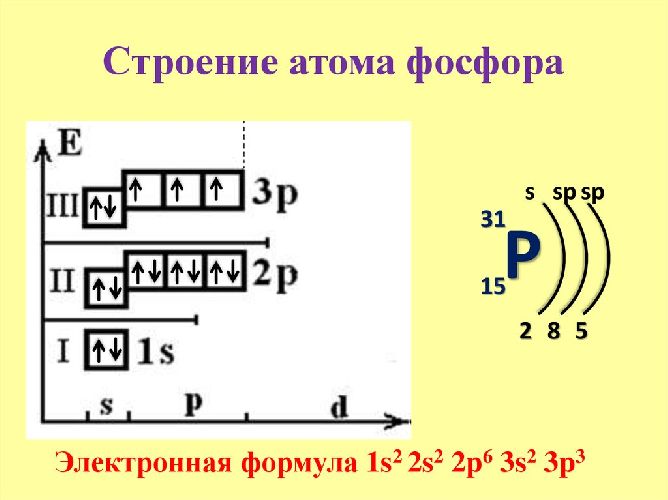
Электронная формула фосфора – 1s22s22p63s23p3.
Физические свойства
Фосфор при нормальных условиях постоянно находится в одном агрегатном состоянии. Это твёрдое кристаллическое вещество, нерастворимое в воде. Относительная атомная масса – 31 а.е.м., молярная масса – 30,9738 г/моль.
Фосфору свойственна аллотропия – способность модифицироваться. Модификации отличаются физическими свойствами фосфора. Особенности видов описаны в таблице.
|
Тип |
tпл., °С |
tкип., °С |
ρ, г/см3 |
Характеристика |
|
Белый |
44 |
280 |
1,823 |
Из-за примесей может иметь жёлтый цвет. Наиболее мягкая модификация, режущаяся ножом, со специфическим запахом. Молекула состоит из четырёх атомов (Р4), расположенных в виде тетраэдра. Окисляется на воздухе со свечением, воспламеняется при 40°С. Токсичен, имеет небольшие смертельные дозы (0,05-0,15 г) |
|
Красный |
593 под давлением 4,36 МПа |
– |
2,4 |
Получается при нагревании белого фосфора в отсутствии воздуха и под ионизирующим излучением. Представляет собой полимер (Pn), состоящий из нескольких молекул Р4. Не ядовитый, не светится. Воспламеняется при 210°С. Не плавится в обычных условиях, а сразу улетучивается. Из паров образуется белый фосфор |
|
Чёрный |
1000 под давлением 18·105 Па |
– |
2,69 |
Получается при длительном нагревании белого фосфора при 230°С под высоким давлением. Имеет металлический блеск. Похож на графит, жирный на ощупь. Не растворяется даже в органических растворителях. Имеет свойства полупроводника. Можно поджечь при предварительном прокаливании до 500°С |
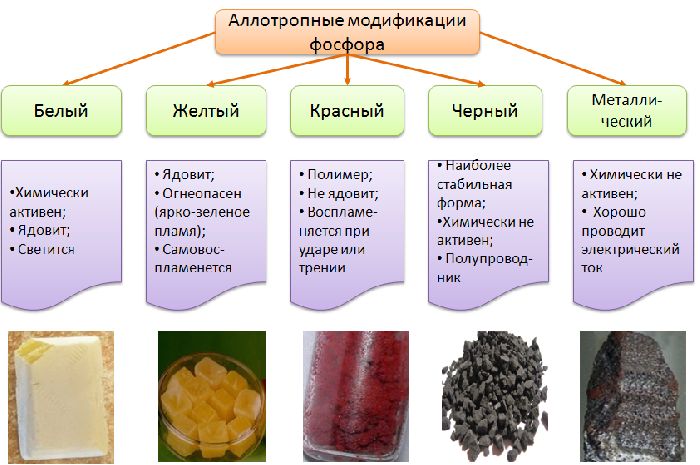
При обычных условиях фосфор имеет только три модификации. Однако под высоким давлением из чёрного фосфора можно получить металлический фосфор. Это самая плотная модификация (3,83 г/см3), проводящая электрический ток.
Химические свойства
Активность снижается при переходе от одной модификации к другой. Поэтому активным является белый фосфор, инертным – металлический.
Фосфор вступает в реакции со многими простыми и сложными веществами. Особенности химических свойств описаны в таблице.
|
Реакция |
Особенности |
Уравнение |
|
С кислородом |
В избытке кислорода образуется оксид фосфора (V). При медленном окислении получается оксид фосфора (III) |
– 4P + 5O2 → 2P2O5; – 4P + 3O2 → 2P2O3 |
|
С галогенами и неметаллами |
Восстанавливает |
– 2P + 3Cl2 → 2PCl3; – B + P → BP |
|
С металлами |
Окисляет. Образует фосфиды |
3Mg + 2P → Mg3P2 |
|
С водой |
Реагирует с водяным паром, образуя фосфин и фосфорную кислоту. Красный фосфор реагирует при нагревании и катализаторе, образуя фосфорную кислоту |
– 8Р + 12Н2О → 5РН3 + 3Н3РО2; – 2Р + 8Н2О → 2Н3РО2 + 5Н2 |
|
С кислотой |
Связывается с водородом, замещая неметаллы |
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O |
|
Со щелочами |
Образует фосфин |
4Р + 3KOH + 3Н2О → РН3 + 3KH2PO2 |
Фосфор не взаимодействует со свободным водородом.
Значение
В природе фосфор встречается в виде солей и минералов. В частности входит в состав апатита.
В организме животных и человека фосфор выполняет структурную функцию. Его содержат:
- белки;
- ДНК;
- АТФ;
- фосфолипиды;
- костная, нервная, мышечная ткани.
Фосфор участвует в постройке клеточной мембраны, в метаболизме, в механизме сокращения мышц. Вместе с кальцием в виде фосфата кальция Са3(PO4)2 придаёт прочность скелету.
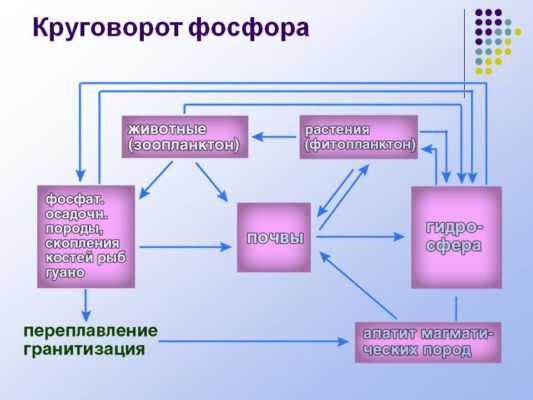
Фосфор участвует в круговороте веществ. Основной источник фосфора – растения, получающие его из почвы. В грунт фосфор попадает в результате гниения. Специальные бактерии перерабатывают органические вещества, содержащие фосфор, в фосфаты – неорганические соединения, усвояемые растениями.
Что мы узнали?
Фосфор – один из важнейших элементов неорганической химии, входящий в состав живых организмов. Электронная конфигурация – 1s22s22p63s23p3. Имеет переменную валентность – III и V.Это твёрдый неметалл, образующий три аллотропические формы – белый, красный и чёрный фосфор. Формы отличаются физическими и химическими свойствами. Самый активный – белый фосфор, окисляющийся на воздухе. Элемент реагирует с кислородом, металлами, неметаллами, галогенами, кислотами, водой и щелочами. Фосфор не реагирует с водородом.