
Фенол – простейший представитель ароматического ряда фенолов. От бензола отличается наличием одной гидроксильной группы -ОН. Другие названия – гидроксибензол, карболовая кислота. Формула – C6H5OH.
- одноатомные – аренолы (фенол и гомологи);
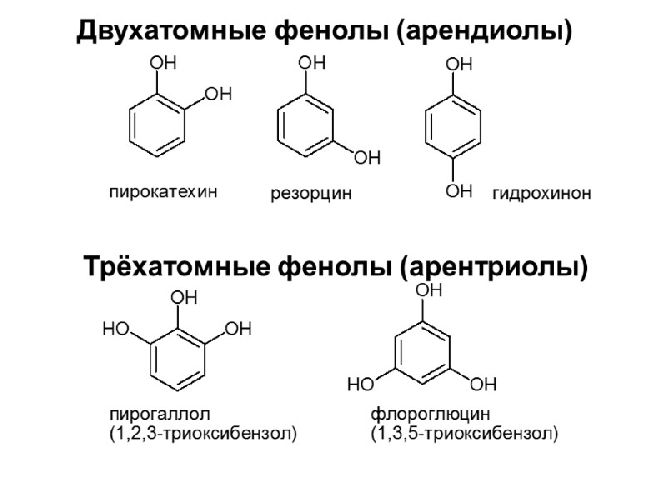
- двухатомные – арендиолы (пирокатехин, резорцин, гидрохинон);
- трёхатомные – арентриолы (флороглюцин, пирогаллол);
- многоатомные.
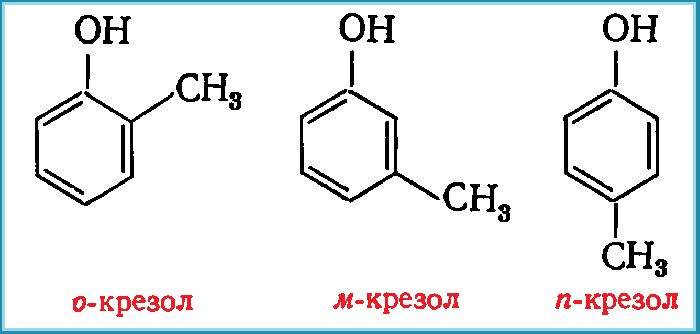
Фенол образует гомологический ряд с общей формулой CnH2n-7OH, где n – не меньше шести. Самые известные гомологи: крезол (С7Н7ОН) и этилфенол (С8Н9ОН).
Кроме того, фенолы классифицируются по количеству ароматических ядер (бензольных колец). Фенол и его гомологи имеют всего одно бензольное кольцо. Также выделяют:
- нафтолы – содержат два ароматических ядра;
- антролы – состоят из трёх бензольных колец;
- фенантролы – включают четыре ароматических ядра;
- бензотетролы – содержат пять бензольных колец.
Наименования фенолов включают:
- числовое перечисление атомов углерода, к которым присоединены заместители и гидроксильные группы;
- приставка, указывающая на количество заместителей и групп -ОН;
- приставка «гидрокси-»;
- название заместителя.
Каждое структурное название заканчивается словом «бензол». Например, 1-гидрокси-2-метилбензол. Это значит, что одна гидроксильная группа присоединена к первому атому углерода, а метильная группа – ко второму.
Другие примеры:
- 1,2,3-тригидроксибензол;
- 1,3 – дигидроксибензол;
- 1-гидрокси-4-метилбензол.
Большинство фенолов имеет тривиальные названия.
Для фенолов характерна структурная изомерия по положению заместителей в бензольном кольце, по строению и количеству радикалов.
Физические свойства
Фенол при нормальных условиях – игольчатые бесцветные кристаллы, розовеющие на воздухе. Это токсичное вещество, вызывающее ожоги.
Основные физические свойства вещества:
- растворимость в воде – 6 г на 100 мл;
- температура плавления – 43°С;
- температура кипения – 183°С;
- плотность – 1,07 г/см3 (тяжелее воды);
- молекулярная масса – 94,11 г/моль.
Фенол получают путём окисления кумола или толуола. Также выделяют из каменноугольной смолы.
Химические свойства
Реактивные способности фенола можно разделить на три группы:
- по связи О-Н (кислотные свойства);
- по бензольному кольцу (реакции замещения);
- качественные реакции.
Основные химические свойства фенола представлены в таблице.
|
Реакция |
Описание |
Уравнение |
|
С активными металлами и щелочами |
Образование солей – фенолятов |
|
|
Нитрование |
Под действием разбавленной азотной кислоты образуется смесь нитрофенолов (орто- и пара-). При воздействии концентрированной кислоты образуется пикриновая кислота (2,4,6-тринитрофенол) |
C6H5OH + 3HNO3 → C6H2(NO2)3OH + 2H2O |
|
Галогенирование |
При комнатной температуре образуется 2,4,6-трибромфенол в виде белого осадка |
C6H5OH + 3Br2 → C6H3Br3O + 3HBr |
|
Гидрирование |
Под действием температуры в присутствии катализатора (никеля) образуется циклогексанол |
C6H5OH + 3H2 → C6H11OH |
|
Качественная |
Обнаружение с помощью хлорида железа (III). Образуется фиолетовый раствор |
6 C6H5OH + FeCl3 → [Fe(C6H5OH)3](C6H5O)3 + 3HCl |
Что мы узнали?
Из урока химии узнали, что фенол – ароматическое соединение, образующее ряд фенолов. Отличается от бензола наличием гидроксильной группы. В зависимости от количества групп выделяют одноатомные, двухатомные, трёхатомные и многоатомные фенолы. Также соединения могут содержать более одного бензольного кольца. Фенол – это токсичное кристаллическое вещества с низкими температурами плавления и кипения. Реакции протекают по гидроксильной группе и по бензольному кольцу. Фенол вступает в реакции с активными металлами, щелочами, азотной кислотой, галогенами, водородом. Нахождение фенола определяется качественной реакцией – воздействием хлорида железа (III).