
Все процессы в природе происходят с сохранением энергии. Об этом говорит Первый Закон термодинамики. При этом энергия может изменять свою форму, и передаваться между телами. Направление передачи энергии устанавливает Второй Закон термодинамики (иногда говорят Второе Начало термодинамики). Кратко рассмотрим его суть.
Однако опыт говорит о том, что таких процессов в Природе не бывает. Следовательно, существует закон, определяющий направление передачи энергии. Этот закон получил название Второго Закона (начала) термодинамики.
Второй Закон термодинамики
Второй Закон термодинамики был сформулирован в работах физика Р.Клаузиуса. Он дал ему следующее определение:
Невозможно перенести тепло от более холодной системы к более горячей без других изменений в обеих системах или окружающих телах.
Замечание «без других изменений» принципиально. Оно говорит о том, что передача тепла от более холодного тела к горячему все же возможна, но при этом необходимо затратить дополнительную энергию.
Второй Закон термодинамики распространяется на любые процессы, в которых изменяется внутренняя энергия тел. Превращение механической энергии в тепло также подчиняется этому закону. Обратный процесс, когда внутренняя энергия тела превратится в механическую, возможен только с затратами дополнительной энергии.
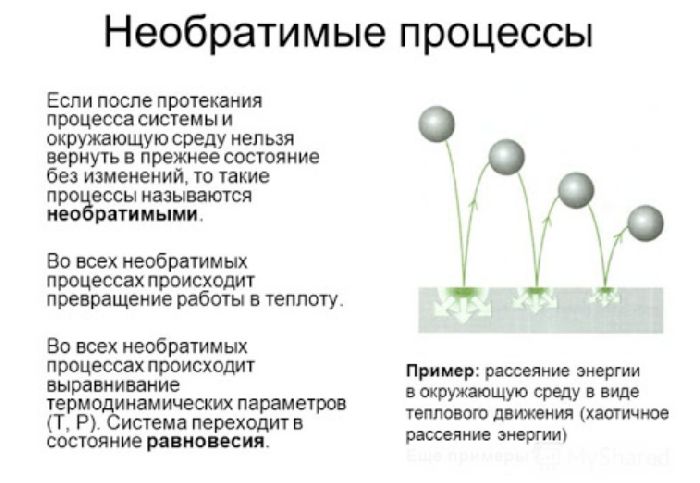
Обратимые и необратимые процессы
Следствием Второго Закона термодинамики является необратимость всех процессов в Природе.
Обратимый процесс – это процесс, который может происходить в прямом и обратном направлении, проходя через одни и те же промежуточные состояния без изменений в окружающих телах. Процесс, который может самопроизвольно протекать только в одном направлении, а для протекания в обратном направлении необходимо внешнее воздействие, называется необратимым.
Поскольку практически во всех процессах в Природе происходит изменение внутренней энергии, все они являются необратимыми. Обратимыми они являются только с некоторой степенью точности. Например, процесс одного колебания маятника можно считать обратимым – прямое и обратное качание груза практически полностью зеркальны.
Энтропия системы
Действие Второго Закона термодинамики объясняется его статистическим характером. Теплота тела характеризует среднюю энергию большого числа его молекул. Среди этих молекул могут быть и более энергичные, и менее энергичные.
Но, для того, чтобы одна часть тела стала теплее, а другая холоднее – необходимо чтобы все более энергичные молекулы оказались в одной части, а все менее энергичные – в другой. В связи с огромным числом молекул в веществе, вероятность такого события можно считать нулевой. Любое же направленное движение – это упорядоченное движение всех молекул тела. Без внешнего воздействия вероятность такого упорядоченного движения также нулевая.
Поэтому, хотя отдельные движения молекул могут быть любыми, макроскопическое состояние системы всегда переходит к более вероятному, более хаотичному. Мерой хаоса системы является специальное понятие – энтропия системы $S$.

Чем выше энтропия системы, тем более беспорядочно движутся ее составляющие. Все процессы в природе текут в сторону увеличения энтропии, поскольку это направление более вероятно.
Таким образом, если тело имеет температуру $T$, и ему передано количество тепла $ΔQ$, то формула второго закона термодинамики будет выражена соотношением:
$$ΔS geq { ΔQ over T}$$
Что мы узнали?
Второй Закон термодинамики гласит, что тепло более горячей системы переходит только в сторону более холодной. Это необратимый процесс, который идет всегда в сторону большего хаоса (в сторону увеличения энтропии). Чтобы тепло перешло от более холодной системы к более горячей, необходимо внешнее воздействие.