
В исследовании поведения газов рассматривается три макроскопических параметра – температура, давление и объем. В общем случае в газовом процессе могут меняться все три параметра. Однако большое значение имеют частные случаи, когда один из параметров постоянен (или почти постоянен). Рассмотрим эти случаи.
И, поскольку в формулу входят три параметра, следовательно, возможны три уравнения состояния изопроцессов:
- изотермическое ($T=const$);
- изобарное ($p=const$);
- изохорное ($V=const$).
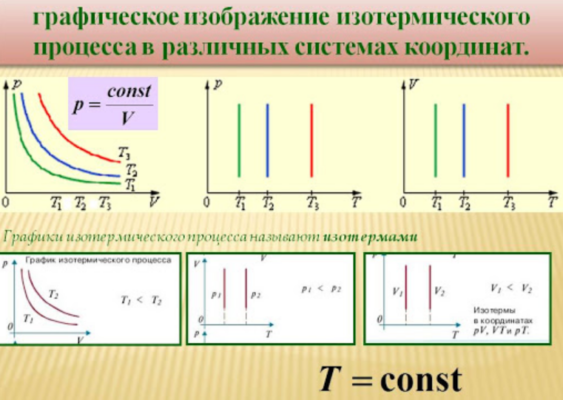
Изотермический процесс
Данный изопроцесс происходит при неизменной температуре. Для этого необходимо, чтобы газ мог свободно обмениваться теплом с окружающей средой, температура которой неизменна. Как правило, такой процесс возможен, если объем газа изменяется очень медленно.
Заменяя в уравнении Клапейрона значение температуры константой, мы получим следующую зависимость:
$${pV}=const$$
То есть, при постоянной температуре давление газа и объем связаны обратной зависимостью. Данное соотношение было доказано Р.Бойлем, и, несколько позже, Э.Мариоттом, поэтому оно носит название закона Бойля-Мариотта.
Уравнение такого процесса (изотерма) в координатах $V-p$ представляет собой гиперболу, располагающуюся тем выше, чем выше температура газа. В других координатах изотерма представляет собой горизонтальную или вертикальную прямую.
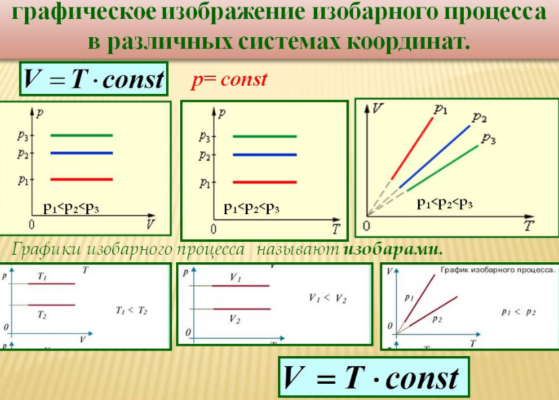
Изобарный процесс
Данный изопроцесс происходит при неизменном давлении газа. Такое возможно, если газ способен свободно менять свой объем, выравнивая давление с атмосферным. Полагая в уравнении Клапейрона давление постоянным, получаем:
$${Vover T}=const$$
То есть, при постоянном давлении объем и температура газа связаны прямой зависимостью. Этот закон был открыт Ж.Гей-Люссаком, и носит его имя.
Уравнение такого процесса (изобара) в координатах $T-V$ представляет собой прямую, выходящую из начала координат, более крутую для более низких давлений (то есть, для более низких давлений при повышении температуры объем увеличивается быстрее). В других координатах изобара представляет собой горизонтальную или вертикальную прямую.
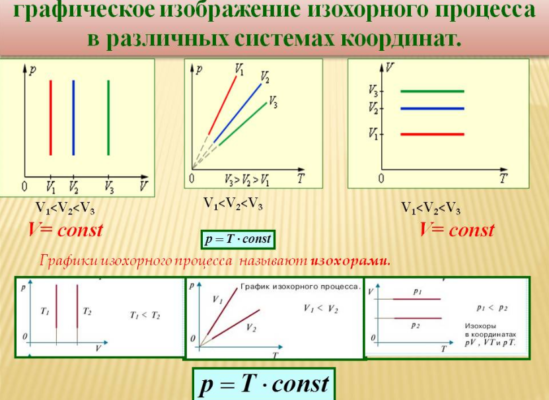
Изохорный процесс
Данный процесс происходит при неизменном объеме газа. Такой изопроцесс возможен, если газ находится в замкнутом объеме, и его давление меняется только в результате подвода тепла. Полагая в уравнении Клапейрона объем постоянным, получаем:
$${pover T}=const$$
То есть, при постоянном объеме давление и температура газа связаны прямой зависимостью. Этот закон был открыт Ж.Шарлем, и носит его имя.
Уравнение такого процесса (изохора) в координатах $T-p$ представляет собой прямую, выходящую из начала координат, более крутую для более малых объемов (то есть, для более малых объемов при повышении температуры давление увеличивается быстрее). В других координатах изохора представляет собой горизонтальную или вертикальную прямую.
Сводная таблица
Для удобства уравнения состояния изопроцессов можно свести в таблицу:
|
Постоянная |
Процесс |
Закон |
Уравнение |
|
T |
Изотермический |
Бойля-Мариотта |
$pV = const$ |
|
p |
Изобарный |
Гей-Люссака |
${Vover T}=const$ |
|
V |
Изохорный |
Шарля |
${pover T}=const$ |
Что мы узнали?
Изопроцесс – это газовый процесс, в котором один из трех макроскопических параметров (объем, давление или температура) неизменен. Существует три изопроцесса – изотермический, изобарный и изохорный, описываемые законами Бойля-Мариотта, Гей-Люссака и Шарля соответственно.