
Все вещества в природе, независимо от температуры и давления, состоят из молекул одного и того же состава. Однако строение вещества отличается при различных внешних условиях. Кратко рассмотрим строение газообразных, жидких и твердых тел.
Влияние давления проследить сложнее, однако тоже возможно: например, измеряя температуру кипения воды в горах, где атмосферное давление заметно ниже. Так, на Крестовом перевале (Военно-Грузинская дорога) вода кипит уже при 92 ⁰С.
Лед, жидкость и пар — это агрегатные состояния воды, строение которых имеет свои особенности. Рассмотрим их с точки зрения молекулярно-кинетической теории (МКТ).
Строение газа
При достаточно высокой температуре и не слишком большом давлении молекулы вещества обладают большой энергией, и сил их взаимодействия недостаточно, чтобы удерживать их рядом. Сила гравитации также оказывается недостаточной, чтобы заметно влиять на поведение молекул. Поэтому при таких условиях молекулы могут свободно перемещаться в пространстве, заполняя весь предоставленный объем.
Молекулы сталкиваются друг с другом и с другими телами, создавая давление газа, однако путь их свободного полета многократно превышает размеры молекул. Взаимодействия происходят лишь в короткое время столкновения. Связь давления с объемом и температурой описывается газовыми законами.

Строение жидкого вещества
Если уменьшать температуру газа, то энергия молекул будет всё меньше, свободный пробег — тоже. Наконец, молекулы в среднем станут находиться настолько близко друг к другу, что силы притяжения начнут играть заметную роль в поведении вещества, выражаясь в виде поверхностного натяжения. Сила тяжести будет также вносить свою лепту: в результате вещество займет нижнюю часть предоставленного объема.
В жидком состоянии молекулы находятся очень близко друг к другу. Поэтому сжать их можно лишь за счет изменения формы молекул, для чего требуется гораздо больше энергии по сравнению со сжатием за счет уменьшения расстояний между молекулами. Большую часть времени молекулы жидкости проводят в беспорядочных колебаниях, но появление даже небольшой внешней силы способно двигать молекулы жидкости, что обеспечивает текучесть.

Строение твердого тела
Если уменьшать температуру жидкости, то наступает момент, когда энергия молекулы становится меньше энергии связи между соседними молекулами. В таком состоянии молекулы выстраиваются в регулярную пространственную структуру с наименьшей потенциальной энергией, называемую кристаллом. Порядок, в котором находятся молекулы внутри кристалла, называется кристаллической решеткой.
В кристалле молекулы не могут менять свое расположение относительно соседей. Уменьшению расстояний мешают силы отталкивания положительных ядер в молекулах, увеличению расстояний — силы притяжения между электронными оболочками и ядрами соседних молекул.
Кристалл сохраняет свою форму даже под действием достаточно больших внешних нагрузок потому, что для ее изменения необходимо разрушить сразу много молекулярных связей.
Сравнительная таблица строения твердых, жидких и газообразных тел представлена ниже:
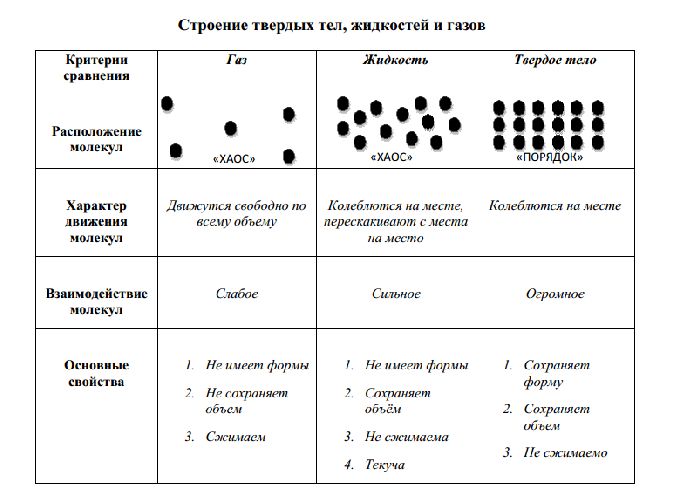
Что мы узнали?
С точки зрения МКТ, газ представляет собой молекулы вещества, имеющие достаточно большую энергию, чтобы независимо двигаться на относительно больших расстояниях друг от друга. В жидкостях молекулы располагаются рядом и начинают взаимодействовать, но всё еще способны двигаться независимо. В твердых телах молекулы выстраиваются в строгую пространственную структуру и не могут двигаться относительно друг друга.